
题目列表(包括答案和解析)
(13分)工业合成氨是硝酸工业中的重要步骤,已知N2(g) +3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
(1) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。

图中t1时引起平衡移动的条件可能是 __ , t3时引起平衡移动的条件可能是 __ ___ , 其中表示平衡混合物 中NH3的含量最高的一段时间是 。
(2) 温度为T ℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的值为 ___________________。请在答题卷上写出具体的计算过程。
(13分)工业合成氨是硝酸工业中的重要步骤,已知N2(g) +3H2(g)  2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
(1) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、 H2和NH3的量),反应速率与时间的关系如右图所示。
H2和NH3的量),反应速率与时间的关系如右图所示。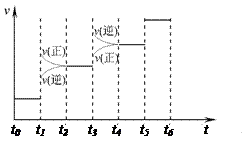
图中t1时引起平衡移动的条件可能是 __ , t3时引起平衡移动的条件可能是 __ ___ , 其中表示平衡混合物中NH3的含量最高的一段时间是 。
(2) 温度为T ℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的值为 ___________________。请在答题卷上写出具体的计算过程。
(13分)工业合成氨是硝酸工业中的重要步骤,已知N2(g) +3H2(g)
 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
(1) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。

图中t1时引起平衡移动的条件可能是 __ , t3时引起平衡移动的条件可能是 __ ___ , 其中表示平衡混合物 中NH3的含量最高的一段时间是 。
(2) 温度为T ℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的值为 ___________________。请在答题卷上写出具体的计算过程。
 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答: H2和NH3的量),反应速率与时间的关系如右图所示。
H2和NH3的量),反应速率与时间的关系如右图所示。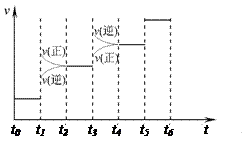
合成氨工业的核心反应是:N2(g)+3H2(g)  2NH3(g) ΔH=Q kJ·mol-1,能量变化如下图,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1,能量变化如下图,回答下列问题:

(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量________ 46.2 kJ(填“<”、“>”或“=”)。
(3)关于该反应的下列说法中,正确的是________。
A.ΔH>0,ΔS>0??????? B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0????? ? D.ΔH<0,ΔS<0
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率________。若升高温度,K值变化________(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中,欲提高合成氨中H2的转化率,下列措施可行的是________(填字母)。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.分离出氨气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com