
题目列表(包括答案和解析)
A.CaCl2和Na2S B.Na2O和Na2O2
C.CO2和CS2 D.HCl和NaOH
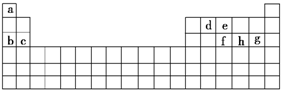
A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:

⑴写出F的基态原子核外电子排布式:__________________。
⑵C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是_________
___________________________________。
⑶由A、B、D三种元素形成的一种物质俗称光气,分子中A原子采取sp2杂化成键。光气分子的结构式是___________,其中碳氧原子之间共价键是_____(填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
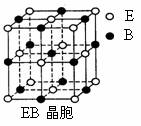
⑷EB晶胞如下图所示,EB晶体中E2+的配位数为_____,EB晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:EB-3401kJ/mol、NaCl-786kJ/mol。导致两者晶格能差异的主要原因是______________________________________________。
⑸现有含F的两种颜色的晶体,一种为紫色,另一为绿色,它们都是配位数为6的配合物(配离子难电离)。相关实验证明,两种晶体的组成皆为FD3?6H2O。为测定这两种晶体的化学式,取等质量的两种晶体分别配成待测溶液,各滴入足量的AgNO3(aq),原绿色晶体的水溶液得到白色沉淀的质量为紫色晶体的水溶液得到白色沉淀质量的2/3 。则紫色晶体配合物的化学式为________________,绿色晶体中含有化学键类型是_______________
(Ⅰ)据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构.
(1)下列有关O4的说法正确的是________
A、O4分子内存在极性共价键B、合成O4的反应可看作核聚变反应,即不属于化学变化
C、O4与O3、O2都是氧的同素异形体D、O4将来可用作更强有力的火箭推进的氧化剂
(2)含O2-、O22-甚至O2+的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:该反应中________(填序号)相当于氧分子的还原.

(3)化合物O2[PtF6]中含有O![]() ,有一种常见的含有O
,有一种常见的含有O![]() 的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:________
的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:________
(Ⅱ)《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13∶1,NO3-的比例呈明显上升的趋势.
回答下列问题:
⑴江苏省大气污染特征是________
A、煤烟型B、机动车尾气型C、由煤烟型向煤烟型与机动车尾气混合型转化
D、由机动车尾气型向煤烟型与机动车尾气混合型转化
⑵某研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究.
①如果你参加该课题的探究,在讨论测定地点时,你建议选择的地点分别是________.
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫.变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是________.
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
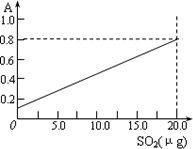
HCHO+H2SO3→![]()
该反应类型属于________.测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量.实验测得SO2含量与溶液的吸光度A的关系如右上图所示.若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为________.
 短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.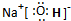
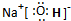
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com