
题目列表(包括答案和解析)
在一密闭的1 L容器里装有4 mol SO2和2 mol O2,在一定条件下开始反应生成SO3。2 min末测得容器中有3.6 mol SO2,试计算:
(1)2 min末SO3的浓度。 (2)2 min内SO2的平均反应速率。
(3)O2的转化率。
在一密闭的1 L容器里装有4 mol SO2和2 mol O2,在一定条件下开始反应生成SO3。2 min末测得 容器中有3.6 mol SO2,试计算:
容器中有3.6 mol SO2,试计算:
(1)2 min末SO3的浓度。 (2)2 min内SO2的平均反应速率。
(3)O2的转化率。
在一密闭的1 L容器里装有4 mol SO2和2 mol O2,在一定条件下开始反应生成SO3。2 min末测得容器中有3.6 mol SO2,试计算:
(1)2 min末SO3的浓度。 (2)2 min内SO2的平均反应速率。
(3)O2的转化率。
 硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+
硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+| 1 | 2 |
CO2 、SO2 、NOx 是对环境影响较大的气体,控制和治理CO2、SO2、NOx 是解决温室效应、减少酸雨和光化学烟雾的有效途径。
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx 浓度的有 (填字母)
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
 c.多步行或乘公交车,少用专车或私家车
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
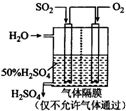
(2)有学者设想以右图所示装置用电化学原理将CO2、SO2 转化为重要化工原料。
若A为CO2,B为H2,C为CH3OH,则通入CO2
的一极为 极;若A为SO2,B为O2,C为H2SO4。则负极的电极反应式为 ;
(3)①在研究氮的氧化物的转化时,某小组查阅到以下数据:17℃、1.01×105 Pa时,
2NO2(g) ![]() N2O4(g) △H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4 和NO2的混合气体达到平衡时,若 c (NO2) = 0.0300 mol?L-1, c (N2O4)= (保留两位有效数字);
N2O4(g) △H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4 和NO2的混合气体达到平衡时,若 c (NO2) = 0.0300 mol?L-1, c (N2O4)= (保留两位有效数字);
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中 c (NO2) = 0.04 mol?L-1, c (N2O4) = 0.007 mol?L-1,则改变的条件为 ;
(4)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。写出用合成气(CO和H2)生产甲醇的化学方程式 ,已知该反应合成1 mol液态甲醇吸收热量131.9 kJ,2![]() (g) + CO(g) +
(g) + CO(g) +![]()
![]() (g) =
(g) = ![]() (g) +2
(g) +2![]() (g) △H =-594.1 kJ?mol-1,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 。
(g) △H =-594.1 kJ?mol-1,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com