
题目列表(包括答案和解析)
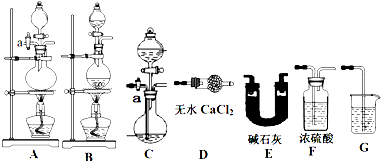
为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ
①称取碳酸钙样品M g
②用c1 mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL。
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1 g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1 g。
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的的公式为_________________________________。
(2)方案Ⅱ中的“冷却”应如何操作?_______________________;理由是____________。
(3)方案Ⅲ中不需要的数据是_____________(填选项编号)。
A.c、V B.c1、V1 C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:______________________________________。
(1)若在滴加NaOH溶液的过程中,生成沉淀的质量m与加入NaOH溶液的体积关系如图所示。请回答:当V1=160mL时,则金属粉末中n(Mg)=_____mol,V2=______mL。
(2)若在滴加NaOH溶液的过程中欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液体积为________ml
(3)若混合物仍为0.1mol其中镁粉的物质的量的分数为a,用100ml2mol/L的硫酸溶解此混合物后再加入450ml1mol/L的氢氧化钠溶液,所得沉淀中无Al(OH)3。满足此条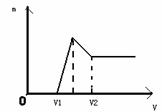 件a的取值范围是__ ___。
件a的取值范围是__ ___。
| (30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol |
| 1g |
| (30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol |
| 1g |
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| V[HCl(aq)]/mL | 11.95 | 12.50 | 12.05 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com