Na
2O
2与水的反应实际是Na
2O
2+2H
2O═2NaOH+H
2O
2,反应放热,反应放出的热量使部分H
2O
2受热分解:2H
2O
2═2H
2O+O
2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
①称取过氧化钠固体2.00g;
②把这些过氧化钠固体放入气密性良好的气体发生装置中;
③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在110mL处恰好与水槽内液面相平;
④将烧瓶中的液体转移到250mL的容量瓶中,然后加入蒸馏水,定容,使液面恰好与刻度相切;
⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO
4溶液去滴定,至终点时用去了24.20mLKMnO
4溶液(此时锰全部以Mn
2+存在)
(1)有500mL、250mL、150mL的量筒备用,应选用量程为
的量筒,理由是
;
(2)有酸式和碱式两种滴定管备用,该实验应选用
,理由是
;
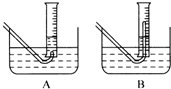
(3)在步骤③测量气体体积时,必须待试管和量筒内的气体都冷却到室温时进行,应选用右图装置中
,理由是
;此时量筒内的液面高于水槽中液面,立即读数会使Na
2O
2的纯度
(填“偏高”“偏低”或“不变”);应进行的操作是
;
(4)在步骤⑤中滴定达到终点时,溶液的颜色变化是
;
(5)该过氧化钠的纯度为
(实验中得到的气体体积均看作为标准状况下).

