(Ⅰ)多项选择题
下列关于化工生产的叙述正确的是
.
A.炼钢就是在高炉中用还原剂把铁从铁矿石中还原出来
B.离子交换膜法制碱工业中,氢氧化钠在电解槽的阴极区产生
C.工业制硫酸中,三氧化硫是在吸收塔内用98%的硫酸吸收
D.黏土是生产陶瓷、玻璃和水泥的共同原料
(Ⅱ)氨是重要的无机化工产品之一,在国民经济中占有重要地位.世界上的氨除少量从焦炉气中回收副产外,绝大部分是合成的氨.海南岛的南海北部湾莺歌海海域有着丰富的天然气气田,利用此资源在东方市八所港建有一家大型的合成氨化肥厂.
(1)写出该化肥厂生产H
2的化学反应方程式
.
(2)在硫酸的工业生产中,往往会增大O
2的比例来提高SO
2的转化率,在合成氨生产中是否会采用相同的方法,请说明理由.
.
(3)在制取原料气体的过程中,常混有一些杂质,在进入合成塔之前必须将杂质除去,原因是
.例如除去CO是先将其氧化成CO
2,然后常用
吸收.
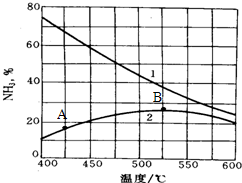
(4)下图是氨的产率与温度的关系,曲线1表示平衡时氨的产率,曲线2表示反应进行一段时间但还未达到平衡时氨的含量.请分析A点氨的含量小于B的原因
.在实际生产中,温度往往采用500℃而不用400℃的原因是
.
(5)在合成氨的生产过程中会产生大量CO
2,该化肥厂与俄罗斯塔氏集团合作,利用这些CO
2建设一个年产52万吨的小颗粒尿素加工厂,再进一步加工成氮磷钾复合肥,请写出该合成尿素反应的化学方程式
,请写出该设计的优点
.


 Fe3+
Fe3+ FeO42-(高铁酸根离子)
FeO42-(高铁酸根离子) 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题: (2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题.
(2008?东莞模拟)某课外活动小组同学用右图装置进行实验,试回答下列问题. 气、氧气、硫酸和氢氧化钾.
气、氧气、硫酸和氢氧化钾.