
题目列表(包括答案和解析)
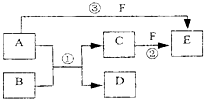 A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),
| ||
| △ |
| ||
| △ |
(18分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程为____________________________________;
得到滤渣1的主要成分为___________________。
⑵ 第②步加H2O2的作用是___________________________________________,使用H2O2的优点是________________________;调溶液pH的目的是使__________________生成沉淀。
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_____________________________。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案: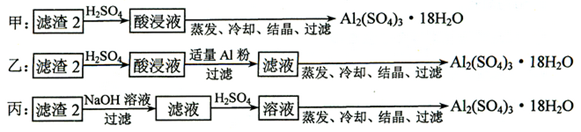
上述三种方案中,_________________方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:
Cu2+ + H2Y2- = CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
在浓盐酸中,H3AsO3与SnCl2反应的离子方程是式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。关于该反应的说法中正确的组合是
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成7.5gAs,还原剂失去的电子为0.3mol ④M为OH- ⑤3SnCl62-是氧化产物
A、①③⑤ B、①②④⑤ C、①②③④ D、只有①③
(12分))A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色;反应③中有水生成,反应②需要放电才能发生,A和D相遇有白烟生成。
(1)反应③的化学方程式为: ;
(2)反应①中每生成1 molC,转移的电子数为 ;
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈 性(填“酸”“碱”或“中”),该水溶液中存在着如下关系,用粒子浓度符号填写。
①c(H+)+ = c(OH—)+ c(Cl—);②c(H+)= c(OH—)+ ;
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式 ;
②X、空气、海水可以组成新型海水标志灯的电池。该电池以海水为电解质溶液,靠的氧气使X不断氧化而源源不断产生电流,只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍。则该新型电池的正极的电极反应式为 ;原电池的总反应方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com