

题目列表(包括答案和解析)
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
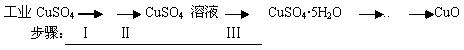
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
⑴ 步骤Ⅰ的目的是除不溶性杂质。所需操作的名称是________、________。
⑵ 步骤Ⅱ的目的是除硫酸亚铁。操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①写出用H2O2溶液除去硫酸亚铁的离子方程式____________________________。
②调整pH 的范围应该在____________之间。
⑶ 步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是将溶液加热蒸发至有晶膜出现时,停止加热,_____________,水浴加热烘干。采用水浴加热的原因是____ 。
⑷ 该同学用CuSO4溶液进行如下探究实验:取A、B两支试管,分别加入 2 mL 5%H2O2溶液,再向H2O2溶液中分别滴入0.1 mol·L-1 FeCl3和CuSO4溶液各1 mL,摇匀,观察到滴入FeCl3 溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确________(填正确或错误),请说明原因 。
(5)16克硫酸铜固体投入水中形成1升溶液,则该溶液显 性(填“酸性”或“碱性”或“中性”),溶液中所有阳离子总数 0.1NA(填“等于”或“大于”或“小于”),若在上述新配制溶液加入稀硫酸再加入铁片产生氢气速率会明显加快,原因是 ;室温下、若在上述新配制溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时c(Cu2+)=________________mol·L-1(Kap[Cu(OH)2]=2.2×10-20)。
| A、常温下硫酸能使铝发生钝化,可用铝制容器贮存浓硫酸 | B、NaHCO3和Al(OH)3都可以用作胃药治疗胃病 | C、一氧化碳和氯气都会对空气产生污染的气体 | D、金属钠与水反应,红热的Fe与水蒸气反应均生成碱和氢气 |
下列关于物质性质和用途的叙述正确的是( )
A.氢氧化铝可用于治疗胃酸过多 B.硅酸钠俗称水玻璃,可用于制备木材防火剂
C.FeO可用作红色油漆和涂料 D.碳化硅可用作砂纸、砂轮的磨料
| A、都可与盐酸反应 | B、都可溶于水 | C、都不能用作耐火材料 | D、都可与氢氧化钠溶液反应 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com