
题目列表(包括答案和解析)
|
将20 mL 0.5 mol/L Al2(SO4)3溶液加水稀释到500 mL,稀释后溶液中SO42-浓度为 | |
| [ ] | |
A. |
0.01 mol/L |
B. |
0.02 mol/L |
C. |
0.03 mol/L |
D. |
0.06 mol/L |
下列四种溶液中,由水电离生成的氢离子浓度之比是( )
①pH=0的盐酸 ②0.1 mol/L的盐酸 ③0.01 mol/L的NaOH溶液 ④pH=14的NaOH溶液
A.1∶10∶100∶1 B.1∶10-1∶10-12∶10-14
C.14∶13∶12∶14 D.14∶13∶2∶1
(共10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)、制水煤气的主要化学反应方程式为: 。
(2)、煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)、利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) CO(g)
CO(g) CH3OH(g)
CH3OH(g) 90.8 kJ
90.8 kJ
② 2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)
H2O(g) 23.5 kJ
23.5 kJ
③ CO(g) H2O(g)
H2O(g) CO2(g)
CO2(g) H2(g)
H2(g) 41.3 kJ
41.3 kJ
总反应:3H2(g) 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g) CO2(g)
CO2(g) Q,其中Q
Q,其中Q kJ;
kJ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a.低温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
(4)、已知某温度下反应②2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率数值(单位相同)的大小: (甲醇)
(甲醇)  (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。
反应开始时 (CH3OH)
(CH3OH) ;
;
该时间内的平均反应速率 (CH3OH)
(CH3OH) ;
;
该温度下反应的平衡常数值为 。(精确到0.01)
在一定体积密闭容器中,进行如下反应:
CO2(g) + H2(g) 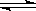 CO(g) + H2O(g),
CO(g) + H2O(g),
其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com