
题目列表(包括答案和解析)
A.溶液中含有0.1 mol Na2SO4
B.1 L溶液中含有14.2 g Na2SO4
C.0.1 mol Na2SO4溶于1 L水中
D.将32.2 g Na2SO4·10H2O溶于少量水后再稀释成1 000 mL
在一密闭容器中进行反应
X2(g)+ 3Y2(g)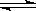 2Z2(g),若 X2、Y2、Z2的起始浓度分别为0.1mol/L、0.3 mol/L、0.2 mol/L,当反应达到平衡后,各物质的浓度有可能是( )
2Z2(g),若 X2、Y2、Z2的起始浓度分别为0.1mol/L、0.3 mol/L、0.2 mol/L,当反应达到平衡后,各物质的浓度有可能是( )
A.c(X2)=0.2 mol/L B.c(Y2)=0.1 mol/L
C.c(Z2)=0.4 mol/L D.c(Y2)=0.6 mol/L
在一密闭容器中进行反应X2(g)+ 3Y2(g)2Z2(g),若 X2、Y2、Z2的起始浓度分别为0.1mol/L、0.3 mol/L、0.2 mol/L,当反应达到平衡后,各物质的浓度有可能是( )
A.c(X2)=0.2mol/L B.c(Y2)=0.1 mol/L
C.c(Z2)=0.4mol/L D.c(Y2)=0.6 mol/L
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
。



(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
[Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol
NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol
NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。

(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
|
弱电解质 |
H2CO3 |
NH3·H2O |
|
电离平衡常数 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+ c(HCO3-)+c(H2CO3)=0.1 mol·L-1
D.c(NH4+)+ c(NH3·H2O)=2c(CO32-)+ 2c(HCO3-)+2c(H2CO3)
(1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。

①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)

①你认为t3时改变的条件是 (填写“加压”或“减压”),B的起始物质的量为 mol;
②各阶段平衡时对应的平衡常数如下表所示:
|
时间段 |
t1~t2 |
t2~t3 |
t3~t4 |
t5~t6 |
|
平衡常数 |
K1 |
K2 |
K3 |
K4 |
用“﹥、﹤、=”符号来表达K1、K2、K3、K4之间的关系 写此条件下该反应的热化学方程式 ________________
(3)工业上一般采用CO(g) + 2H2(g)  CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。
下表所列数据是该反应在不同温度下的化学平衡常数的数值:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
①某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率为 ,此时的温度 250℃(填“>”、“<”、“=”)
②如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
(填“甲醇”或“氧气”),b处电极上发生的电极反应是: 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com