
题目列表(包括答案和解析)
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应的离子方程式为 ,其平均反应速率υ(NO3-)为 mol·L-1min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如图所示。

①电源正极为 (填A或B),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为 g。
电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。
(1)如图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________。
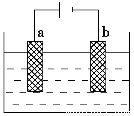
AgNO3—HNO3溶液
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
①写出电极反应式:阴极________________,阳极________________。
②当生成1 mol Cr(OH)3时,电路中转移电子的物质的量至少为________mol。
③电解过程中有Fe(OH)3沉淀生成,原因是___________________________。
(3)电解降解法可用于治理水中硝酸盐的污染。电解降解NO3-的原理如图所示。
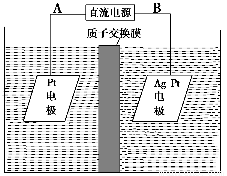
电源正极为________(填A或B),阴极反应式为______________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应的离子方程式为 ,其平均反应速率υ(NO3-)为 mol·L-1min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如图所示。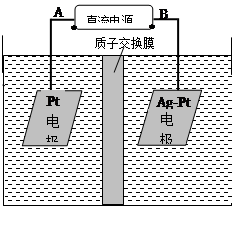
①电源正极为 (填A或B),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为 g。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com