
题目列表(包括答案和解析)
|
在如图所示的电路中,有一烧杯中盛有Ba(OH)2溶液,由滴管逐滴向烧杯中加H2SO4溶液至过量,则灯泡L和电流表
| |
A. |
L先亮后暗, |
B. |
L逐渐变暗, |
C. |
L先亮后暗, |
D. |
L先暗后亮, |
 50mL 0.5mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
50mL 0.5mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.请回答下列问题: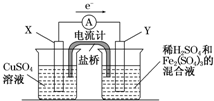 (2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)2- 4 |
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | 负 负 |
铜 铜 |
Cu-2e-═Cu2+ Cu-2e-═Cu2+ |
| Y极 | 正 正 |
碳 碳 |
2Fe3++2e-═2Fe2+ 2Fe3++2e-═2Fe2+ |
 用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).2- 4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com