
题目列表(包括答案和解析)
分析下列两个氧化还原反应,回答下列问题:
化学反应:①KClO3+6HCl===KCl+3Cl2↑+3H2O
②2H2SO4(浓)+Cu![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
问题:反应中什么物质是氧化剂?什么物质是还原剂?参加反应的某物质是否全为氧化剂或全为还原剂?
(14分)过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~F涉及H2O2的反应,回答相关问题:
A.Na2O2 +2HCl= 2NaCl+H2O2
B.Ag2O+ H2O2=2Ag+O2↑+ H2O
C.2 H2O2=2 H2O+O2↑
D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O
E.H2O2+MnSO4 = MnO2 + H2SO4
F. H2O2 + Fe2+ + H+ == Fe3+ + H2O
(1)上述反应不属于氧化还原反应的是(填代号)_____________。
(2)H2O2仅体现还原性的反应是(填代号) 。
(3)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(4)H2O2体现酸性的反应是(填代号) 。
(5)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: 。
(6)通过以上反应分析, H2O2常称为绿色氧化剂,原因是_______________________。
(7)请配平化学反应F,并画出电子转移情况。
H2O2 + Fe2+ + H+ == Fe3+ + H2O
(8)由于H2O2有较强氧化性,能使某些有色试剂褪色,具有漂白作用,另外它还有弱酸性,某学生将H2O2溶液滴入含有酚酞的氢氧化钠溶液中,观察到溶液的红色消失。为了探究溶液褪色的原因,该学生提出了两种假设,然后又设计了一个简单的实验方案,以验证这两种假设。请回答:
(A)该学生提出的两种假设是:
假设①___________________________________________;
假设② _________________________________ 。
(B)将该学生设计的简单实验方案、预测的实验现象及结论填入下表(结论部分只需填①或②):
|
简单实验方案 |
预测的实验现象 |
结论 |
|
|
|
假设____成立 |
|
|
假设____成立 |
对下列两个氧化还原反应回答问题:
(1)以双线桥表示出反应中的电子转移情况以及反应物被氧化、被还原的情况.
(2)分析说明什么物质是氧化剂,什么物质是还原剂.
化学反应:①2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
②Cl2+2NaOH=NaCl+NaClO+H2O
⑴(8分)甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量,所得固体是 (填化学式);写出该反应的离子方程式________________________ __。
 乙组:气体分析法
乙组:气体分析法
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,(将选项填入空格中)
A.氢氧化钠溶液 B.饱和氯化钠溶液 C.饱和碳酸氢钠溶液
选用该溶液后实验结果还是不准确,原因是_________________________________。
⑵(5分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:
① Zn+盐酸;② Na+水;③ Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如下图(原实验)所示的装置图,请回答下列问题:
①写出Al和NaOH溶液反应的化学方程式 。
② 实验小组在点燃用此装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是 。
③ 实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。

在改进后的实验中H2的生成速率减慢。原因是 。
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最
近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,
MnFe2O4的制备流程如下:
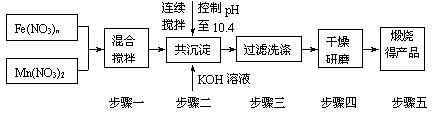
(1)投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为___________。
(2)步骤二中“连续搅拌”的目的是__________________________;
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4![]() MnFe2O4-x+
MnFe2O4-x+![]() O2↑
O2↑
MnFe2O4-x+xH2O→MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
① 从理论上讲,该循环中,1 mol H2O能制 mol H2
② 若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为______。
③ 针对MnFe2O4热化学循环制氢过程存在的不足,你认为热化学循环制氢还需要
解决的化学问题是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com