
题目列表(包括答案和解析)
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |

| 元素素素素 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
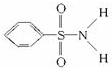 ,其中S-N中,你认为共用电子对偏向
,其中S-N中,你认为共用电子对偏向下面是某些短周期元素的x值:
元素符号 | Li | Be | B | C | O | F |
x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
元素符号 | Na | Al | Si | P | S | Cl |
x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg、N的x值范围:__________<x(Mg)<__________,__________<x(N)<__________。
(2)推测x值与原子半径的关系是__________,短周期元素x值变化特点,体现了元素性质的__________变化规律。
(3)经验规律告诉我们:当成键的两原子相应元素的差值Δx>1.7时,一般为离子键;当Δx<1.7时,一般为共价键。试推断AlBr3中化学键类型是__________。
(4)预测元素周期表中,x值最小的元素位置:____________________(放射性元素除外)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com