
题目列表(包括答案和解析)
某同学用0.1×10×25mm、质量分数≥99.5%的铝片和酸反应制取H2,实验现象如下表:
时间 酸 | 1min | 2 min | 5 min | 15 min | 20 min |
3mol?L-1HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
1.5mol?L-1H2SO4 | 均无明显现象(无气泡) | ||||
①写出上述铝与酸反应的离子方程式 。
②反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是 。
③为探究铝与盐酸反应比铝与硫酸反应快的原因,有同学猜测是由于SO42-离子对Al和H+的反应起阻碍作用,请你设计一个实验证明这种猜想是否正确,写出操作过程、现象和结论 。
| 1min | 2min | 5min | 15min | 20min | |
| 3mol/L HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L H2SO4 | 均无明显现象(只有少量气泡) | ||||
(9分)某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表: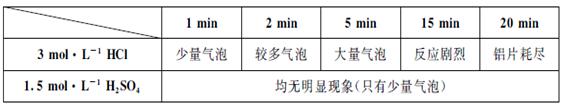
(1)写出铝片与盐酸、硫酸反应的离子方程式
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用, 对该反应不影响。
对该反应不影响。
假设二: 。
假设三: 。]
假设四: 。
③ 请你以“假设一”为实验课题,设计实验方案探究,要求写 出主要实验步骤。
出主要实验步骤。
(9分)某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表:

(1)写出铝片与盐酸、硫酸反应的离子方程式
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用, 对该反应不影响。
对该反应不影响。
假设二: 。
假设三: 。]
假设四: 。
① 请你以“假设一”为实验课题,设计实验方案探究,要求写出主要实验步骤。
(9分)某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表:
(1)写出铝片与盐酸、硫酸反应的离子方程式
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,对该反应不影响。
假设二: 。
假设三: 。]
假设四: 。
① 请你以“假设一”为实验课题,设计实验方案探究,要求写出主要实验步骤。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com