
题目列表(包括答案和解析)
下列叙述中不正确的是
A.静电除尘治理悬浮颗粒物污染,其依据是胶体的电泳原理
B.“候氏制碱法中”,在饱和的NaCl溶液中先通入NH3,再通入CO2
C.水的离子积常数随温度的升高而增大,60℃时0.01mol/LNaOH 溶液PH =12
D.叠氮酸与醋酸的酸性相似,在NaN3的水溶液中存在离子浓度:c(Na+)> c(N3-)> c(OH-)> c(H+)
下列叙述中不正确的是
| A.静电除尘治理悬浮颗粒物污染,其依据是胶体的电泳原理 |
| B.“候氏制碱法中”,在饱和的NaCl溶液中先通入NH3,再通入CO2 |
| C.水的离子积常数随温度的升高而增大,60℃时0.01mol/LNaOH 溶液PH=12 |
| D.叠氮酸与醋酸的酸性相似,在NaN3的水溶液中存在离子浓度:c(Na+)> c(N3-)> c(OH-)> c(H+) |
(1)浓度均为0.1mol?L-1的8种溶液:①HNO3 ②H2SO4 ③HCOOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl,溶液的pH由小到大的顺序是_________________________(填写编号)。
(2)在硫化氢的饱和溶液中存在的电离平衡是:
①其中[HS-]_________[S2-],[HS-]_______[H+],[H+]_______[S2-](填“>”、“<”或“=”)。
②若加NaOH固体,[S2-]将_________(填“增大”、“减小”或“不变”,下同),S2-的物质的量将________,溶液的pH将_________。
③若加入无水CuSO4,[S2-]将__________,溶液的pH将_________。
(12分)已知在K2CrO4的溶液中存在着如下的平衡:
(1)浅黄色难溶化合物BaCrO4和过量的硫酸作用后,能产生白色沉淀,则有关的离子方程式为:
(2)向K2Cr2O7溶液中加入Pb(NO3)2并充分搅拌后,溶液的pH明显降低,其原因是:
(3)用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中Cr2O72-的浓度小于10-5mol/L。则配制时除K2Cr2O7、H2O外还用到的试剂是:KOH ,溶液的pH应:( ) 8.5 (填大于、等于或小于多少)。
(4)在碱性(c OH- = 1 mol/L)介质中铬和过氧化氢分别有如下的元素电势图:
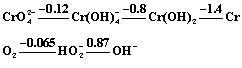
把H2O2写成HO2-的原因是: ; 向KCr(SO4)溶液中,加过量的NaOH和过量的H2O2,则HO2-参与反应的离子方程式为:
下列叙述中不正确的是
A.静电除尘治理悬浮颗粒物污染,其依据是胶体的电泳原理
B.“候氏制碱法中”,在饱和的NaCl溶液中先通入NH3,再通入CO2
C.水的离子积常数随温度的升高而增大,60℃时0.01mol/LNaOH 溶液PH =12
D.叠氮酸与醋酸的酸性相似,在NaN3的水溶液中存在离子浓度:c(Na+)>c(N3-)> c(OH-)> c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com