
题目列表(包括答案和解析)
(18分)下列八个步骤是用来分析一种含铅锡的合金中铅和锡的个别含量
(1)称量0.4062g的合金,放在烧杯中,用11mol?L-1的HCl和16mol?L-1的HNO3溶液溶解样品。在此过程中铅和锡分别被氧化成Pb(II)、Sn(VI)。
(2)再加热5分钟,以赶走氮和氯的氧化物后,使溶液冷却;此时会有一些锡化合物和一种铅化合物沉淀出。
(3)加入25.00mL 0.2000mol?L-1的Na2H2EDTA(可用H2Y2-表示)溶液后,沉淀会溶解成一透明无色的溶液。
(4)上述溶液全部移入250.0mL的量瓶中,并用蒸馏水稀释到量瓶的刻度上。
(5)拿出25.00mL,加入30%的Hexamine(如下图)溶液15mL、H2O及两滴的类苯酚橙(以XO代表)(如下图)当指示剂,此溶液的pH值为6。
(6)再用标准0.009970mol?L-1的硝酸铅Pb(NO3)2 溶液滴定从第(5)步骤中的黄色透明的溶液,直至颜色刚好由黄色变到红色,此实验值为24.05mL。
(7)取2.0g的固体NaF加入滴定瓶中,此时溶液会变回黄色。
(8)再用0.009970mol?L-1的硝酸铅滴定到颜色变红,此实验值为15.00mL。
Hexamine和类苯酚橙(XO)的结构式如下:
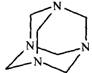
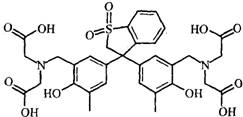
Hexamine 类苯酚橙(XO)
Hexamine的pKb =9.5。类苯酚橙(XO)在pH小于4时是红色,pH大于5时是黄色
回答下列问题
10-1 在步骤(2)中铅的沉淀物是什么?写出其化学式。
10-2 写出步骤(3)中沉淀消失的离子反应方程式(必须平衡)?记得此溶液的pH值为6。
10-3 步骤(5)中为何加入Hexamine?
10-4 加入类苯酚橙(XO)的目的为何?
10-5 写出步骤(6)中,(i)在滴定过程中,以及(ii)滴定终点造成颜色变化时的平衡离子反应方程式。
10-6 步骤(7)中,加入NaF的目的为何?
10-7 写出步骤(7)中的平衡离子方程式。
10-8 用平衡的离子方程式来说明为什么步骤(7)中的颜色会由红变为黄?用XO代表类苯酚橙。
10-9 计算此合金中Pb的重量百分比,再另外计算此合金中Sn的重量百分比。
pH均为6的盐酸和NH4Cl溶液,其中水电离出的c(H+)值分别是x mol·L-1、y mol·L-1,两者的关系是 ( )
A.相等 B.x>y C.x=10-2y D.x=102y
已知在t1、t2温度下水的电离平衡曲线如图所示,则下列说法中不正确的是

A.t1<t2
B.一定温度下,改变水溶液中c(H+)或 c(OH-)的浓度,Kw不会发生变化
C.t2温度pH值为2的HCl溶液中,水电离出的c(H+)=1×10-10mol·L-1
D.将t1温度下0.1 mol·L-1的盐酸稀释,溶液中所有离子的浓度均相应减小
(1)25℃时,某NaCl溶液中c(Cl–)=1×10-4 mol·L–1,则该溶液中c(Na+)∶c(OH-)=
(2)25℃时,将0.1 mol·L–1NaOH溶液与0.06 mol·L–1的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH= 。25℃时,pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近 。
(3)25℃时,下列四种溶液中,①pH=0的盐酸 ②0.1 mol·L–1的盐酸 ③0.01 mol·L–1的NaOH溶液 ④pH=11的NaOH溶液,由水电离生成氢离子浓度之比①︰②︰③︰④是: (填字母)
A.1︰10︰100︰1000 B.0︰1︰12︰11
C.14︰13︰12︰11 D.14︰13︰2︰3
(4)某温度(t℃)时,测得0.01mol·L-1 的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH- )=________。
③该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,pH=______________
(5) 纯水中c(H+)=5.0×10–7 mol·L–1,则此时纯水中的c(OH–) = ;若温度不变,滴入稀硫酸使c(H+)=5.0×10–3 mol·L–1,则c(OH–) = ;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH–)=5.0×10–2 mol·L–1,则溶液中c(H+)= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com