
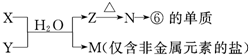
题目列表(包括答案和解析)


| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 还原性 |
H2SO3+Br2+2H2O=H2SO3+2HBr H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 酸性 |
H2SO3+2NaOH=Na2SO3+2H2O H2SO3+2NaOH=Na2SO3+2H2O |
| ||
| 冰晶石 |
| ||
| 冰晶石 |
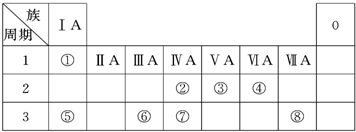
根据下表,用化学式或元素符号回答下列问题:
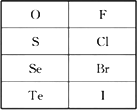
(1)还原性最强的离子是________;
(2)H2Te的稳定性比HI________;
(3)已知:2F2+2H2O![]() 4HF+O2,Cl2+H2S
4HF+O2,Cl2+H2S![]() 2HCl+S↓,完成下列化学方程式:
2HCl+S↓,完成下列化学方程式:
Br2+H2Se![]() ________;
________;
I2+H2Te![]() ________.
________.
| ||




| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com