(2013?上海二模)某实验小组设计了下列装置进行氨的催化氧化实验.
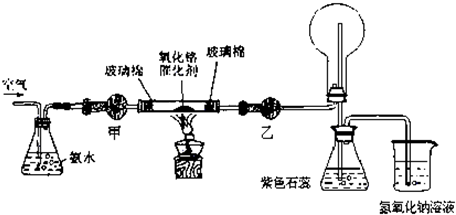
(1)常温下,氨水的浓度为1:1.5(28%的浓氨水和水的体积比)时实验现象明显,配制该浓度氨水的玻璃仪器有
量筒、烧杯、玻璃棒
量筒、烧杯、玻璃棒
.
(2)本实验用的干燥剂是碱石灰和无水氯化钙.则甲处是
碱石灰
碱石灰
;乙处是
无水氯化钙
无水氯化钙
.
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是
放
放
(填“吸”或“放”)热反应;化学方程式为
.
(4)实验前,烧杯中盛有200mL 1.000mol/L的 NaOH溶液,实验后测得烧杯中溶液的pH=13,且溶液质量比反应前增加了7.48g,则NaOH溶液吸收的NO和NO
2的物质的量之比是
5:13
5:13
(设溶液的体积不变且忽略盐类的水解).
(5)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟.其原因可用化学方程式表示为:
4NO+3O2+2H2O=4HNO3或2NO+O2=2NO2和3NO2+H2O=2HNO3+NO
或4NO2+O2+2H2O=4HNO3;
4NO+3O2+2H2O=4HNO3或2NO+O2=2NO2和3NO2+H2O=2HNO3+NO
或4NO2+O2+2H2O=4HNO3;
、
NH3+HNO3=NH4NO3
NH3+HNO3=NH4NO3
.
(6)已知NH
3和N
2常压下的沸点分别为:-33.5℃和-195.8℃,据此推测这两种物质中,能做制冷剂的是
NH3
NH3
(填分子式);能用来冷冻物质的是
N2
N2
(填分子式).






 如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).
如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度). 4NO
(g)+6
H2O (g);该反应是一个可逆反应,正反应是放热反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
4NO
(g)+6
H2O (g);该反应是一个可逆反应,正反应是放热反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )