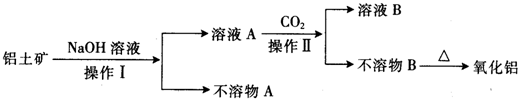
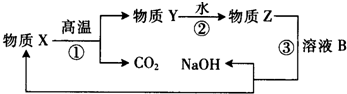
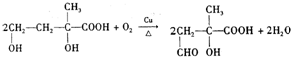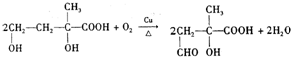在有机化合物中,由于基团之间的相互影响,会使有机物分子中相关原子或原子团的反应活性发生显著的变化.
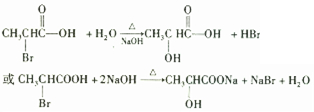
①实验表明,丙酸CH
3CH
2COOH分子中“-CH
2-”上的碳氢键因与“-COOH”相邻,反应活性明显增强,比如,在红磷存在时,丙酸可与液溴反应生成2-溴丙酸(CH
3CHBrCOOH).
②已知含有“-C=C=C-”结构的有机物不能稳定存在.请结合①②有关信息,分析如下转化关系,图中所用NaOH都是足量的,回答问题:
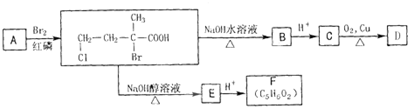
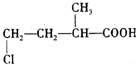
(1)A的结构简式为
;图中A所发生的反应类型是
取代反应
取代反应
; F中所含官能团的名称是
碳碳双键、羧基
碳碳双键、羧基
.
(2)C→D的化学方程式为
.
(3)D不可能发生的反应是
a
a
(填字母代号).
a.水解反应 b.消去反应 c.中和反应 d.酯化反应 e.氧化反应
(4)F有多种同分异构体,其中含有-C≡C-且属于甲羧酯类的有机物共有
4
4
种,写出其中在核磁共振氢谱中有四个吸收峰的结构简式
HCOOCH2CH2C≡CH、HCOOCH(CH3)C≡CH
HCOOCH2CH2C≡CH、HCOOCH(CH3)C≡CH
.

 若A~E均为单官能团有机物,它们之间有如下转化关系:
若A~E均为单官能团有机物,它们之间有如下转化关系:



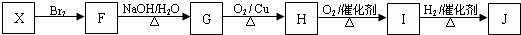
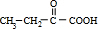
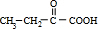
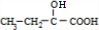
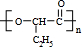 +nH2O
+nH2O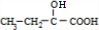
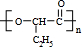 +nH2O
+nH2O