(2010?西城区模拟)如图所示反应I、反应II和反应III均是工业生产中常见的反应.其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应III和E与G反应的原理相同.
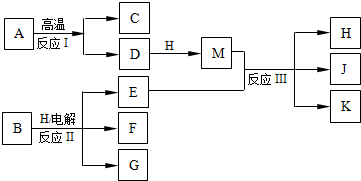
(1)C的电子式是
.
(2)反应II的离子方程式是
.
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是
Ca(ClO)2═CaCl2+O2↑
Ca(ClO)2═CaCl2+O2↑
.
(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I
2,然后用Na
2S
2O
3标准溶液滴定I
2,计算出结果.
①用Na
2S
2O
3标准溶液滴定I
2时选用的指示剂是
淀粉
淀粉
.
②生成I
2的反应的离子方程式是
ClO-+2I-+2H+=Cl-+I2+H2O
ClO-+2I-+2H+=Cl-+I2+H2O
.
(5)已知:2Fe
2++Br
2=2Fe
3++2Br
-.若将0.1mol E通入100mL FeBr
2溶液中,溶液中有三分之一的Br
-被氧化成Br
2,则此反应离子方程式是
6Fe2++4Br-+5Cl25Cl2-═6Fe3++2Br2+10Cl-
6Fe2++4Br-+5Cl25Cl2-═6Fe3++2Br2+10Cl-
,原FeBr
2溶液的物质的量浓度为
1.2 mol/L
1.2 mol/L
.




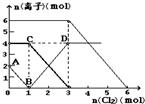 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-;2Fe3++2I-=2Fe2++I2.则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-;2Fe3++2I-=2Fe2++I2.则下列有关说法中,不正确的是( ) 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2.则下列说法中不正确的是( ) (2010?济南一模)向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
(2010?济南一模)向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )