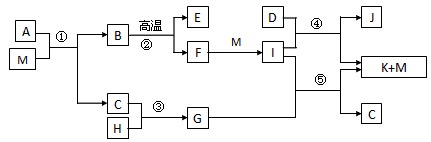
已知M是无色液体,C、H、D是有刺激性气味的气体,且D是单质,E为三原子非极性分子,②是工业上制取F的反应,J为漂白粉的有效成份。(部分反应条件未列出)
请回答下列问题:
(1)E、D、J的化学式分别是___________、___________、___________,G的电子式___________
(2)反应④的化学方程式______________________
(3)简述C的一种用途:___________
(4)A由三种元素组成,1mol A与M反应可生成1mol B和2mol C,则A的化学式是___________
(5)漂白粉常用作消毒剂、杀菌剂、漂白剂等。漂白粉是一种混合物,漂白粉质量高低由"有效氯"(过量酸与漂白粉作用生成的氯气的质量与漂白粉的质量比)决定。漂白粉样品2.00克,加水研磨后,转入250毫升容量瓶内,用水稀释至刻度,摇匀后,取出25.0毫升,加入过量的KI溶液和过量的稀硫酸,静置。待漂白粉放出的氯气与KI完全反应后,用0.100摩/升的Na2S2O3标准溶液滴定反应中生成的碘。反应如下
2Na2S2O3+I2=Na2S4O6+2NaI滴定时用去Na2S2O3溶液20.0毫升。计算该漂白粉中有效氯的百分含量。已知漂白粉与酸的反应为:Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2↑+2H2O