
题目列表(包括答案和解析)
(11分)
(1)H2O2的水溶液为二元弱酸,科学家对H2O2结构的认识经历了较为漫长的过程,最初他们提出了两种观点:
a.(式中O→O表示共用电子对由前一个氧原子提供)和 b.H—O—O—H
①请用电子式表示b的结构 。
②写出H2O2在水溶液中的电离方程式 。
(2)①用单质碘和氯酸钾可以制得碘酸钾,其中涉及的一个反应为:
I2 + KClO3 + H2O → KH(IO3)2+ KCl + Cl2↑.因此有人认为I2的氧化性强于氯气,你
(填“同意”或“不同意”)该观点,理由是 。
②用电化学方法也可以制碘酸钾.原理是以石墨为阳极,不锈钢为阴极,以碘化钾溶液为电解质溶液,在一定电流和温度下进行电解(同时不断搅拌电解质溶液)其电解总反应式为:![]()
![]()
![]() 试写出阳极的电极反应式 。
试写出阳极的电极反应式 。
(11分)
(1)H2O2的水溶液为二元弱酸,科学家对H2O2结构的认识经历了较为漫长的过程,最初他们提出了两种观点:
a.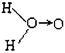 (式中O→O表示共用电子对由前一个氧原子提供)和 b.H—O—O—H
(式中O→O表示共用电子对由前一个氧原子提供)和 b.H—O—O—H
①请用电子式表示b的结构 。
②写出H2O2在水溶液中的电离方程式 。
(2)①用单质碘和氯酸钾可以制得碘酸钾,其中涉及的一个反应为:
I2 + KClO3 + H2O → KH(IO3)2 + KCl + Cl2↑.因此有人认为I2的氧化性强于氯气,你
(填“同意”或“不同意”)该观点,理由是 。
②用电化学方法也可以制碘酸钾.原理是以石墨为阳极,不锈钢为阴极,以碘化钾溶液为电解质溶液,在一定电流和温度下进行电解(同时不断搅拌电解质溶液)其电解总反应式为: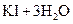

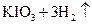 试写出阳极的电极反应式 。
试写出阳极的电极反应式 。
(11分)
(1)H2O2的水溶液为二元弱酸,科学家对H2O2结构的认识经历了较为漫长的过程,最初他们提出了两种观点:
a.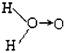 (式中O→O表示共用电子对由前一个氧原子提供)和
b.H—O—O—H
(式中O→O表示共用电子对由前一个氧原子提供)和
b.H—O—O—H
①请用电子式表示b的结构 。
②写出H2O2在水溶液中的电离方程式 。
(2)①用单质碘和氯酸钾可以制得碘酸钾,其中涉及的一个反应为:
I2 + KClO3 + H2O → KH(IO3)2 + KCl + Cl2↑.因此有人认为I2的氧化性强于氯气,你
(填“同意”或“不同意”)该观点,理由是 。
②用电化学方法也可以制碘酸钾.原理是以石墨为阳极,不锈钢为阴极,以碘化钾溶液为电解质溶液,在一定电流和温度下进行电解(同时不断搅拌电解质溶液)其电解总反应式为: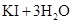

 试写出阳极的电极反应式
。
试写出阳极的电极反应式
。
(1)H2O2的水溶液为二元弱酸,科学家对H2O2结构的认识经历了较为漫长的过程,最初他们提出了两种观点:
a.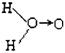 (式中O→O表示共用电子对由前一个氧原子提供)和 b.H—O—O—H
(式中O→O表示共用电子对由前一个氧原子提供)和 b.H—O—O—H
①请用电子式表示b的结构 。
②写出H2O2在水溶液中的电离方程式 。
(2)①用单质碘和氯酸钾可以制得碘酸钾,其中涉及的一个反应为:
I2 + KClO3 + H2O → KH(IO3)2 + KCl + Cl2↑.因此有人认为I2的氧化性强于氯气,你
(填“同意”或“不同意”)该观点,理由是 。
②用电化学方法也可以制碘酸钾.原理是以石墨为阳极,不锈钢为阴极,以碘化钾溶液为电解质溶液,在一定电流和温度下进行电解(同时不断搅拌电解质溶液)其电解总反应式为:![]()
![]()
![]() 试写出阳极的电极反应式 。
试写出阳极的电极反应式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com