
题目列表(包括答案和解析)
A.前者大于后者 B.前者小于后者 C.前者等于后者 D.不能确定
pH=3的盐酸和pH=3的醋酸溶液,由水电离产生的c(H+)( )
A.前者大于后者 B.前者小于后者 C.前者等于后者 D.不能确定
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 请回答:
⑴ 写出醋酸钠在水中发生水解反应的离子方程式: ;
⑵ 在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);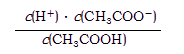
⑶ 25℃时,醋酸的电离平衡常数表达式Ka= 。0.10mol/L的醋酸溶液的pH约为 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)
可近似视为仍等于0.10mol/L; 已知:lg1.3=0.114);
⑷ 对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解。
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离。
⑸ 物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹ 常温时,有以下3种溶液,其中pH最小的是

⑺ 已知醋酸能![]() 够和小苏打溶液发生下列反应:
够和小苏打溶液发生下列反应:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH试纸在常温下分别测定![]() 0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
1. 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质
C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质
D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。
你认为上述方案可行的是________________________________。
2. 一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_____ ____,②同体积同物质的量浓度的三种酸,中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是_________ ③当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序___________ ④将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________
3.某温度(t ℃)时, KW=10-13,将此温度下pH=1的硫酸溶液aL与pH=12的氢氧化钡溶液bL混合。
①若所得混合液为中性,则a:b= 。
②若所得混合液的pH=2,则a:b= 。
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 请回答:
⑴ 写出醋酸钠在水中发生水解反应的离子方程式: ;
⑵ 在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);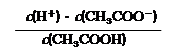
⑶ 25℃时,醋酸的电离平衡常数表达式Ka= 。0.10mol/L的醋酸溶液的pH约为 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)
可近似视为仍等于0.10mol/L; 已知:lg1.3=0.114);
⑷ 对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解。
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离。
⑸ 物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹ 常温时,有以下3种溶液,其中pH最小的是
⑺ 已知醋酸能够和小苏打溶液发生下列反应:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com