
题目列表(包括答案和解析)
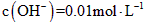 的KOH溶液;②
的KOH溶液;②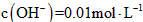 的Ba(OH)2溶液;③
的Ba(OH)2溶液;③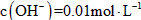 的氨水;④
的氨水;④ 的氨水。
的氨水。 (一)(3分)下列实验操作不正确的是 _。
A.在催化剂存在的条件下, 苯和溴水发生反应可生成无色、![]() 比水重的液体溴苯
比水重的液体溴苯
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,
完成乙醇氧化为乙醛的实验
C.醇中含有少量水可加入硫酸铜再蒸馏制得无水乙醇
D.试管中先加入一定量浓硫酸,再依次加入适量浓硝酸、苯,然后加热制取硝基苯
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀
刚好溶解为止
G.验证溴乙烷水解产![]() 物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、
物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、
待液体分层后,滴加硝酸银溶液
(二)(7分)乙醇分子中的羟基在一定条件下可以被氧化为醛基,为验证此性质,有关实验如下:
(1)在试管中加入2mL乙醇,把一端弯成螺旋状的铜丝在酒精灯外焰加热后立即插入乙醇中,反复操作几次后把铜丝晾干称重,发现其质量未发生变化,由此可推测铜丝的作用是 ,反应方程式为: 。
 (2)某化学兴趣小组认为上述实验操作简单,但
(2)某化学兴趣小组认为上述实验操作简单,但
通过实验得到的信息量较少。他们对此实验
进行了完善(如图,夹持仪器略去)。指导老师首先肯定了同学们的学习积极性,并提出
以下意见:
优点:实验原理正确,相对实验(1)而言,在
反应产物的检验方面有较大改进。
缺点:加热时乙醇汽化速率不易控制,有可能
造成C装置中产生倒吸现象。
注意:B装置若加热温度过高,可能存在安全隐患!
同学们因此又对实验进行研讨和改进:
① A处采用了水浴加热的方式,这样做的好处是:
② C装置可改用以下 装置(填字母)。

③ 实验时可对B部分采取合理的操作方法以防止安全隐患,请对此提出你的意见:
(16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
 2SO3(g)
2SO3(g) 2SO3(g) △H= 。
2SO3(g) △H= 。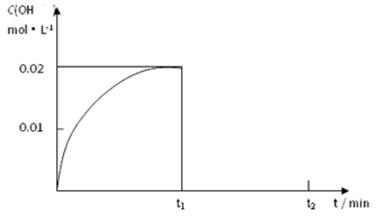
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com