
题目列表(包括答案和解析)
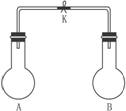
图1
编号 | ① | ② | ③ | ④ |
A中气体 | H2S | N2 | NH3 | NO |
B中气体 | SO2 | Cl2 | HCl | O2 |
A. ②③④① B.③①④② D.③②①④ D. ④③②①
研究硫及其化合物对于工农业生产具有重要意义。
(1)图Ⅰ所示一个容积为4L的密闭容器,内有可移动的隔板。一定温度(T)下,左室加入2 mol SO3,右室加入2 mol SO2和1 mol O2,在少量催化剂存在下分别发生反应:

左室: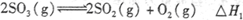
右室:
反应达到平衡时,右室反应过程和能量关系如图Ⅱ所示。
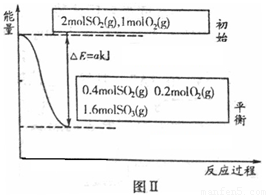
①ΔH2=_______(含a的数学式表示);反应的平衡常数K=_________L·mol-1。
②能说明两边反应一定达到平衡的是______________(填序号)。
A.隔板不再移动
B.左右两边SO2的物质的量相等
C.左右二室中SO2与O2物质的量之比都是2∶1
③达平衡时,左室反应吸收的热量为Q1kJ,右室反应吸收的热量为Q2kJ,则Q1、Q2满足的关系是_____________(填序号)。
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
(2)高温下,炽热的Cu2S与水蒸气反应生成金属铜、H2和SO2(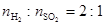 )。
)。
①写出该反应的化学反应方程式_____________________________________________。
②若有1 mol Cu2S参与反应,则转移电子的物质的量是_________mol。
研究硫及其化合物对于工农业生产具有重要意义。
(1)图Ⅰ所示一个容积为4L的密闭容器,内有可移动的隔板。一定温度(T)下,左室加入2 mol SO3,右室加入2 mol SO2和1 mol O2,在少量催化剂存在下分别发生反应:
左室:
右室:
反应达到平衡时,右室反应过程和能量关系如图Ⅱ所示。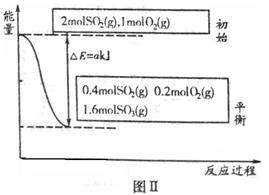
①ΔH2=_______(含a的数学式表示);反应的平衡常数K=_________L·mol-1。
②能说明两边反应一定达到平衡的是______________(填序号)。
A.隔板不再移动
B.左右两边SO2的物质的量相等
C.左右二室中SO2与O2物质的量之比都是2∶1
③达平衡时,左室反应吸收的热量为Q1kJ,右室反应吸收的热量为Q2kJ,则Q1、Q2满足的关系是_____________(填序号)。
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
(2)高温下,炽热的Cu2S与水蒸气反应生成金属铜、H2和SO2(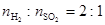 )。
)。
①写出该反应的化学反应方程式_____________________________________________。
②若有1 mol Cu2S参与反应,则转移电子的物质的量是_________mol。




 )。
)。
| ||
| ||
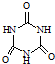
| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com