
题目列表(包括答案和解析)
CO2和CO是工业排放的对环境产生影响的废气。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)科学家们提出用工业废气中的CO2制取甲醇:CO2+3H2CH3OH+H2O。制得的CH3OH可用作燃料电池的燃料。
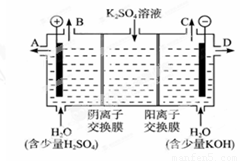
①在KOH介质中,负极的电极反应式为_________________________________。
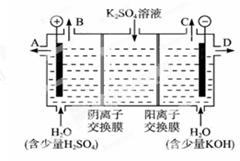
②作介质的KOH可以用电解K2SO4溶液的方法制得。则KOH在_______出口得到,阳极的电极反应式是:_____________________________________。
(3)利用CO与H2反应可合成CH3OCH3。
已知:3H2(g)
+ 3CO(g) 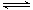 CH3OCH3(g)
+ CO2(g),ΔH=-247kJ/mol
CH3OCH3(g)
+ CO2(g),ΔH=-247kJ/mol
在一定条件下的密闭容器中,该反应达到平衡,要提高CO的转化率,可以采取的措施是 .
A.低温高压;B.加入催化剂;C.体积不变充入氦气;D.增加CO的浓度;E.分离出二甲醚
(4)CH3OCH3也可由CH3OH合成。已知反应2CH3OH(g)
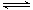 CH3OCH3(g)
+ H2O(g),在某温度下,在1L密闭容器中加入CH3OH
,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
CH3OCH3(g)
+ H2O(g),在某温度下,在1L密闭容器中加入CH3OH
,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.01 |
0.2 |
0.2 |
①0-10 min内反应速率v(CH3OH) = 。
②该温度下的平衡常数为 。
③若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:
v正 v逆 (填“>”、“<”或“=”)。
CO2和CO是工业排放的对环境产生影响的废气。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)科学家们提出用工业废气中的CO2制取甲醇:CO2+3H2CH3OH+H2O。制得的CH3OH可用作燃料电池的燃料。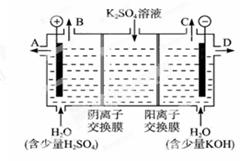
①在KOH介质中,负极的电极反应式为_________________________________。
②作介质的KOH可以用电解K2SO4溶液的方法制得。则KOH在_______出口得到,阳极的电极反应式是:_____________________________________。
(3)利用CO与H2反应可合成CH3OCH3。
已知:3H2(g) + 3CO(g) 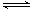 CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
在一定条件下的密闭容器中,该反应达到平衡,要提高CO的转化率,可以采取的措施是 .
| A.低温高压; | B.加入催化剂; | C.体积不变充入氦气; | D.增加CO的浓度;E.分离出二甲醚 |
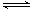 CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.01 | 0.2 | 0.2 |
 CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol| A.低温高压; | B.加入催化剂; | C.体积不变充入氦气; | D.增加CO的浓度;E.分离出二甲醚 |
 CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.01 | 0.2 | 0.2 |
(13分)近些年来,世界各地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫等是导致极端天气的重要因素,研究这些化合物的综合处理具有重要意义。
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 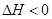 ,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g) NH2COONH4(s)
NH2COONH4(s) 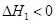
第2步:NH2COONH4(s) CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 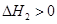
下列示意图中[a表示2NH3(g)+ CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+ H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号) 。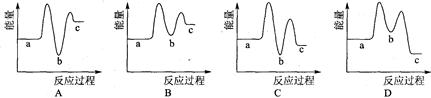
(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3
的转化率随时间的变化关系如图所示。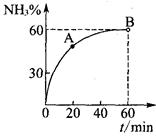
①A点的逆反应速率v逆(CO2) B点的逆反应速率
v逆 (CO2)(填“﹤”“﹥”或“=”)。
②达到平衡时,CO2的转化率为 。
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入 0.100molNO 和2.030mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 物质 物质n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 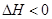 ,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
,该反应在 (填“较高温度”或“较低温度”)下能自发进行。 NH2COONH4(s)
NH2COONH4(s) 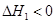
 CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 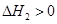


 物质 物质n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com