
题目列表(包括答案和解析)
2013年春季,全国各地持续出现严重的雾霾天气,给人们的生产、生活造成了严重的影响。汽车尾气中含有CO、氮氧化物、烟尘等污染物,是导致雾霾天气的原因之一。请回答下列有关问题。
(1)下列说法正确的是________。
A.NO、CO、CO2均为酸性氧化物
B.CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出
行
C.汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(2)为减轻污染,北京为汽车加装了“三效催化净化器”,可将尾气中的CO、NO转化为参与大气循环的无毒混合气体,反应如下:2NO+2CO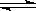 N2+2CO2,则该反应的化学平衡常数表达式K=________。
N2+2CO2,则该反应的化学平衡常数表达式K=________。
(3)已知下列热化学方程式:
N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-1①
2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·mol-1②
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1③
则汽车尾气转化反应2NO(g)+2CO(g)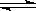 N2(g)+2CO2(g)的ΔH=________。
N2(g)+2CO2(g)的ΔH=________。
(4)当固体催化剂质量一定时,增大其表面积可加快化学反应速率。如图表示在其他条件不变时,反应2NO(g)+2CO(g)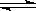 N2(g)+2CO2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。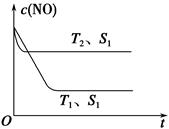
①图中T1________T2(填“>”或“<”)。
②若催化剂的表面积S1>S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。
(5)低温脱硝技术可用于处理各种废气中的氮氧化物,发生的化学反应为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
A.反应中每转移3 mol电子,生成标准状况下N2的体积为22.4 L
B.平衡时,若其他条件不变,增大NH3的浓度,废气中氮氧化物的转化率
减小
C.因为反应物比生成物的物质的量少,所以反应物比生成物的能量低
D.其他条件不变时,使用高效催化剂,废气中氮氧化物的转化率增大
 N2+2CO2,则该反应的化学平衡常数表达式K=________。
N2+2CO2,则该反应的化学平衡常数表达式K=________。 N2(g)+2CO2(g)的ΔH=________。
N2(g)+2CO2(g)的ΔH=________。 N2(g)+2CO2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
 2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
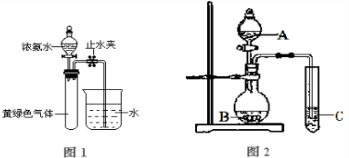
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
完成下列填空:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3(aq)反应探究脱氮原理。实验前
①用0.1mol·L-1H2SO4(aq)洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;
②将KNO3(aq)的pH调至2.5;
③为防止空气中的 (写化学式)对脱氮的影响,应向KNO3溶液中通入N2。
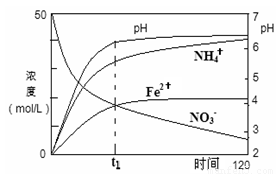
(2)用足量Fe粉还原上述KNO3(aq)过程中,反应物与生成物的离子浓度、pH随时间的变化关系如图所示。请根据图中信息写出t1时刻前该反应的离子方程式: 。
(3)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中被氧化与被还原的元素的原子个数之比为 。如果反应中有5mol电子发生转移,可得到肼 g。
(4)常温下向25mL 0.01mol/L稀盐酸中缓缓通入5.6 mL NH3(标准状况,溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是 。在通入NH3的过程中溶液的导电能力 (填写“变大”、“变小”或“几乎不变”)。
(5)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是 (选填编号)。
a.c(Cl-)=c(NH4+)>c(H+)=c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(6)常温下向25mL含HCl 0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡 (填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为 mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com