
题目列表(包括答案和解析)

由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域。
(1)V2O5是接触法制硫酸的催化剂。下图为硫酸生产过程中2SO2
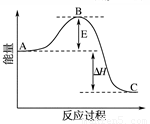
(g) + O2(g)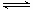 2SO3(g)
ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g)
ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
①V2O5的使用会使图中B点 (填“升高”、“降低”)。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为 mol/L;生成SO3的化学反应速率为 mol/(L·min)。
(2)下图是一种以铜、稀硫酸为原料生产蓝矾的生产流程示意图。
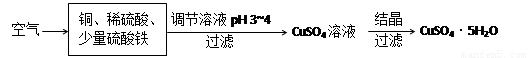
①生成CuSO4的总反应为2Cu+O2+2H2SO4=2 CuSO4+2H2O,少量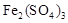 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成:
第一步:Cu+2Fe3+=2Fe2++Cu2+
第二步: 。(用离子方程式表示)
②调节溶液pH为3~4的目的是 ,调节时加入的试剂可以为 。(选填序号)
a.NaOH溶液 b.CuO粉末 c.Cu2(OH)2CO3 d.氨水
(3)纳米TiO2是优良的光敏催化剂。工业上用钛铁矿制得粗TiO2;再转化为TiCl4(l);由TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
①写出TiO2和焦炭、氯气反应生成TiCl4和CO的热化学方程式: 。
②写出上述TiCl4(l)制取纳米TiO2的化学方程式: 。
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域。
(1)V2O5是接触法制硫酸的催化剂。下图为硫酸生产过程中2SO2 (g) + O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
①V2O5的使用会使图中B点 (填“升高”、“降低”)。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为 mol/L;生成SO3的化学反应速率为 mol/(L·min)。
(2)下图是一种以铜、稀硫酸为原料生产蓝矾的生产流程示意图。
①生成CuSO4的总反应为2Cu+O2+2H2SO4=2 CuSO4+2H2O,少量 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成:
第一步:Cu+2Fe3+=2Fe2++Cu2+
第二步: 。(用离子方程式表示)
②调节溶液pH为3~4的目的是 ,调节时加入的试剂可以为 。(选填序号)
a.NaOH溶液 b.CuO粉末 c.Cu2(OH)2CO3 d.氨水
(3)纳米TiO2是优良的光敏催化剂。工业上用钛铁矿制得粗TiO2;再转化为TiCl4(l);由TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
①写出TiO2和焦炭、氯气反应生成TiCl4和CO的热化学方程式: 。
②写出上述TiCl4(l)制取纳米TiO2的化学方程式: 。
 2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。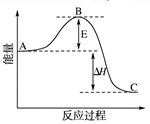
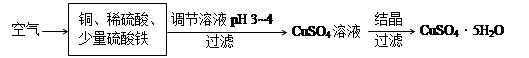
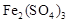 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com