
题目列表(包括答案和解析)
| ||
| ||
| ||
| ||
Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)_________。向上述溶液中滴入过量的CaCl2溶液,观察到的现象是__________________。
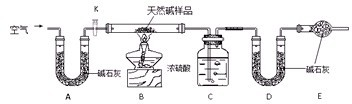
Ⅱ.某天然碱的组成为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数)。现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为

请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明_______________________。
(2)NaHCO3受热分解的化学反应方程式为________________________________________。
(3)E处碱石灰的作用是__________________________________________________。
(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是__________________。
(5)实验结束后称得洗气瓶C质量增加
(10分)碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀_________(填操作步骤)、洗涤、烘干、称量。洗涤沉淀的操作是________________________________。
方案二:气体分析法
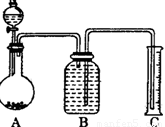
(2)把一定量的样品与足量盐酸反应后,用如图装置测
定产生CO2气体的体积,为了测定结果准确,B中
的溶液最好采用____________,从下列各选项中选
取:
a.饱和碳酸钠溶液 b.饱和碳酸碳酸氢钠溶液.
c.饱和氢氧化钠溶液 d.饱和硫酸铜溶液。
若直接采用如图装置, 选用该溶液后实验结果仍
然不够准确,其原因可能是________________________________________。
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用如图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度.该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g ②取n g样品装入广口瓶中 ③检验装置的气密性。④缓慢鼓入空气数分钟,再称量干燥管质量为w g ⑤关闭止水夹 ⑥打并止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟。
I.正确的操作顺序是(填写序号):
③→_______→⑥→________→⑤→_______→⑦→__________→④
Ⅱ.若去掉装置A,测定结果___________;若去掉装置B,测定结果__________(填“偏大”、“偏小”或“无影响”).
(10分)碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀_________(填操作步骤)、洗涤、烘干、称量。洗涤沉淀的操作是________________________________。
方案二:气体分析法
(2)把一定量的样品与足量盐酸反应后,用如图装置测
定产生CO2气体的体积,为了测定结果准确,B中
的溶液最好采用____________,从下列各选项中选
取:
a.饱和碳酸钠溶液 b.饱和碳酸碳酸氢钠溶液.
c.饱和氢氧化钠溶液 d.饱和硫酸铜溶液。
若直接采用如图装置, 选用该溶液后实验结果仍
然不够准确,其原因可能是________________________________________。
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用如图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度.该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g ②取n g样品装入广口瓶中 ③检验装置的气密性。④缓慢鼓入空气数分钟,再称量干燥管质量为w g ⑤关闭止水夹 ⑥打并止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟。
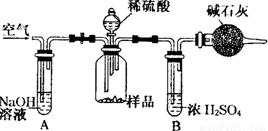
I.正确的操作顺序是(填写序号):
③→_______→⑥→________→⑤→_______→⑦→__________→④
Ⅱ.若去掉装置A,测定结果___________;若去掉装置B,测定结果__________(填“偏大”、“偏小”或“无影响”).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com