
题目列表(包括答案和解析)
 位于元素周期表前四周期的五种元素A、B、C、D、E,原子序数依次增大.A元素原子的最外层电子排布可表示为:asaap2a,B元素在地壳中含量居第二位,C与B位于同一周期,且是该周期元素中电负性最大的元素,D元素的+3价离子的3d亚层为半充满,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.
位于元素周期表前四周期的五种元素A、B、C、D、E,原子序数依次增大.A元素原子的最外层电子排布可表示为:asaap2a,B元素在地壳中含量居第二位,C与B位于同一周期,且是该周期元素中电负性最大的元素,D元素的+3价离子的3d亚层为半充满,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.
 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是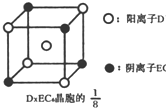
| 元素 | Mn | Fe | |
| 电离 能/kJ?mol-1 |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
今年初爆发的农夫山泉与统一饮料的“砒霜门事件”引起了人们对砷的生理作用的关注。砒霜是砷的氧化物,化学式为As2O3,砷在周期表中与氢、磷属于同族元素。该族元素与生物体的生命活动密切相关。被称为“生命之族”。如氮、磷是生物体中不可缺少的元素,在生命体中占有板其重要的地位。而砷和锑的某些化合物则有毒,所以中世纪的西方炼金术上曾分别用毒蛇和狼来作为砷和锑的符号。

|
(2)下列关于该元素的说法中正确的是 。
a.氮、磷、砷的电炙性依次减小
b.氮、磷、砷的气态氢化物分子的稳定性依次减弱
c.N-H、P-H、Aa—H键的健长依次增长,而键的极性依次降低
d.P4分子的空间的构壁为正四面体(如右图),P-P键之间的键角为109°28′
(3)氯是化肥中的主要元素,某种盐类物质是常见的氮肥成分,其中氮元素同时显示最高化合价和最低化合价,请写出该物质的化学式 。该化合物的组成元素中基态原子的第一电离徒最大的是 。
(4)“砒霜门事件”使不少人谈砷色变。实际上,砷是人体必需的微量元素,砷缺乏将导致生长海缓、骨骼异常等症状。只要控制砒霜的量,适当使用可以治病。
近代常用马氏试砷法检验砒霜的含量。其方法是用Zn、盐酸和试样混合,若试样中有As2O2存在,就会发生反应①:As2O3+Zn+HCl→X+ZnCl2+H2O(未配平)。在试管中加热X则发生反应②,可看到亮黑色的“砷镜”,并得到一种还原性气体单质。
写出反应①配平后的化学方程式 。若试样的质量为100g得到磷镜的质量为1.5g,反应①中转移电子的数目为 。
今年初爆发的农夫山泉与统一饮料的“砒霜门事件”引起了人们对砷的生理作用的关注。砒霜是砷的氧化物,化学式为As2O3,砷在周期表中与氢、磷属于同族元素。该族元素与生物体的生命活动密切相关。被称为“生命之族”。如氮、磷是生物体中不可缺少的元素,在生命体中占有板其重要的地位。而砷和锑的某些化合物则有毒,所以中世纪的西方炼金术上曾分别用毒蛇和狼来作为砷和锑的符号。
|
(2)下列关于该元素的说法中正确的是 。
a.氮、磷、砷的电炙性依次减小
b.氮、磷、砷的气态氢化物分子的稳定性依次减弱
c.N-H、P-H、Aa—H键的健长依次增长,而键的极性依次降低
d.P4分子的空间的构壁为正四面体(如右图),P-P键之间的键角为109°28′
(3)氯是化肥中的主要元素,某种盐类物质是常见的氮肥成分,其中氮元素同时显示最高化合价和最低化合价,请写出该物质的化学式 。该化合物的组成元素中基态原子的第一电离徒最大的是 。
(4)“砒霜门事件”使不少人谈砷色变。实际上,砷是人体必需的微量元素,砷缺乏将导致生长海缓、骨骼异常等症状。只要控制砒霜的量,适当使用可以治病。
近代常用马氏试砷法检验砒霜的含量。其方法是用Zn、盐酸和试样混合,若试样中有As2O2存在,就会发生反应①:As2O3+Zn+HCl→X+ZnCl2+H2O(未配平)。在试管中加热X则发生反应②,可看到亮黑色的“砷镜”,并得到一种还原性气体单质。
写出反应①配平后的化学方程式 。若试样的质量为100g得到磷镜的质量为1.5g,反应①中转移电子的数目为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com