
题目列表(包括答案和解析)
碘及其化合物在人类活动中占有重要地位。
(1)加碘食盐中含有碘酸钾(KIO3),工业上以电解法制备碘酸钾,电解设备如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:
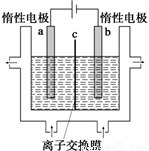
3I2+6KOH=5KI+KIO3+3H2O,再将该溶液加入 (阴极、阳极)区,另将氢氧化钾溶液加入另外一个区。使用 (阴、阳)离子交换膜,在阳极发生的电极反应式: 。
(2)碘化氢不稳定,分解反应的热化学方程式是2HI(g) I2(g)+H2(g)
ΔH=+9.48 kJ·mol-1已知ΔS>0
I2(g)+H2(g)
ΔH=+9.48 kJ·mol-1已知ΔS>0
①该反应属于( )
A.任何温度均自发 B.任何温度均不自发 C.高温自发 D.低温自发
②一定条件下,反应在一个带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,缩小体积,平衡常数不变
B.恒温,缩小体积,平衡不移动,颜色加深
C.恒容,升温,正向反应速率和逆向反应速率均增大
D.恒容,在容器中若投入2mol HI,达到平衡时吸收9.48 kJ 的热量
③一定温度下,平衡常数K=1/4,在2L的容器中,加入4molHI发生反应达到平衡,HI的转化率 。
碘及其化合物在人类活动中占有重要地位。
(1)加碘食盐中含有碘酸钾(KIO3),工业上以电解法制备碘酸钾,电解设备如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应: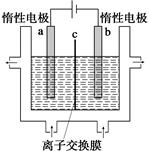
3I2+6KOH=5KI+KIO3+3H2O,再将该溶液加入 (阴极、阳极)区,另将氢氧化钾溶液加入另外一个区。使用 (阴、阳)离子交换膜,在阳极发生的电极反应式: 。
(2)碘化氢不稳定,分解反应的热化学方程式是2HI(g)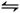 I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
①该反应属于( )
A.任何温度均自发 B.任何温度均不自发 C.高温自发 D.低温自发
②一定条件下,反应在一个带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,缩小体积,平衡常数不变
B.恒温,缩小体积,平衡不移动,颜色加深
C.恒容,升温,正向反应速率和逆向反应速率均增大
D.恒容,在容器中若投入2mol HI,达到平衡时吸收9.48 kJ 的热量
③一定温度下,平衡常数K=1/4,在2L的容器中,加入4molHI发生反应达到平衡,HI的转化率 。

 I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0已知2NO2(g)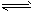 N2O4(g)
ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g)
ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧, 并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答下列有关问题
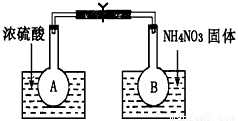
(1)观察到的实验现象为:_____________________________
(2)由实验现象可知,升高温度,该化学平衡向___________(填“正”或“逆”)反应方向移动,反应中NO2的转化率将_______________(填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30mL针筒中分别抽入10mLNO2气体,将针筒前端封闭。实验过程中第一支针筒不做任何操作,仅作为实验现象观察时的参照对象。
(3)某同学将第二支针筒活塞迅速推至5mL处,此时气体的颜色变深,一段时间后气体颜色又变浅了。试解释一段时间后气体颜色又变浅的原因:________________________。
(4)某同学将第三支针筒活塞迅速拉至20mL处。
①该同学观察到的现象是:__________________________
②在此过程中,该反应的化学平衡常数将______________(填“增大”、“减小”或“不变”)。
已知2NO2(g) N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧, 并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答下列有关问题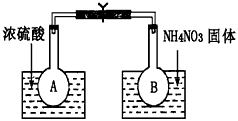
(1)观察到的实验现象为:_____________________________
(2)由实验现象可知,升高温度,该化学平衡向___________(填“正”或“逆”)反应方向移动,反应中NO2的转化率将_______________(填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30mL针筒中分别抽入10mLNO2气体,将针筒前端封闭。实验过程中第一支针筒不做任何操作,仅作为实验现象观察时的参照对象。
(3)某同学将第二支针筒活塞迅速推至5mL处,此时气体的颜色变深,一段时间后气体颜色又变浅了。试解释一段时间后气体颜色又变浅的原因:________________________。
(4)某同学将第三支针筒活塞迅速拉至20mL处。
①该同学观察到的现象是:__________________________
②在此过程中,该反应的化学平衡常数将______________(填“增大”、“减小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com