
题目列表(包括答案和解析)
 如图所示是实验室蒸馏石油的实验装置,实验需要收集60~150℃和150~300℃的馏分.请回答下列问题:
如图所示是实验室蒸馏石油的实验装置,实验需要收集60~150℃和150~300℃的馏分.请回答下列问题: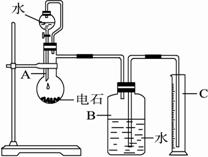
(1)烧瓶中发生反应的化学方程式是_____________________。装置B和C的作用是______________________。烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了_______________________。容器A中弯曲的玻璃管的作用是__________________________。
(2)所用的电石质量不能太大,否则__________;也不能太小,否则__________。若容器B的容积为250mL,则所用的电石质量应在__________g左右(从以下数据选填:0.30、0.60、1.00、1.50、2.00)。
(3)实验室能否用启普发生器制乙炔,其原因是_______________________________。
(4)为了得到比较平稳的乙炔气流,常可用_____________代替水。
(5)实验中测得排入量筒中水的体积为VmL(1.01×105Pa,
| O | - 4 |
| ||



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com