
题目列表(包括答案和解析)
NO很容易与许多分子迅速发生反应,科学家发现在生命体中会不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
1、实验室用金属铜和稀硝酸制取NO的化学方程式:________.
最适宜的收集方法是________.

2、NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示.实验室用小铜粒做实验,在使用上述装置进行实验时,可用丝状材料包裹铜粒进行,这丝状材料的成分可以是________(填选项编号)
A.铁
B.铝
C.玻璃
用丝状材料包裹的原因是________.

3、将上图中分液漏斗的活塞打开,使反应进行,在分液漏斗中看到________色气体.原因是(填化学方程式):________.
4、为证明铜丝与稀硝酸反应生成的确实是NO,某同学另设计了一套如图所示制取NO的装置.

在带有铜丝的塞子插入硝酸的同时拔去左边的塞子,反应发生,再过一段时间后发现反应会自动停止,其原因是________.
5、在上题反应结束后右管上端可以看到有一段无色气体,为了验证该气体为NO,能否将带铜丝的塞子拔去?________(能、不能),理由是________.
6、若带铜丝的塞子不拔去,将左管的塞子塞上后,只需一个简单的操作即可验证无色气体为NO,该操作是________;过一段时间后,气体颜色慢慢变浅,其原因是________.
(16分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
第1步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
第2步:H2NCOONH4(l)H2O(l)+H2NCONH2(l) △H2=+226.3 kJ·mol-1
(1)写出工业合成尿素的热化学方程式:
(2)下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.添加高效催化剂 D.定时分离尿素
(3)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= 。
(4)工业上合成氨常与尿素生产联合进行以提高经济效益,合成氨的热化学方程式如下:
N2(g) + 3H2(g) 2NH3(g) △H = —92.4 kJ/mol
请在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)。
(5)有一工业投产前小实验:在一定温度和压强下,将6 molH2和2 molN2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数约为11.1%(即1/9),此时H2的转化率是多少?(写出计算过程,计算结果保留3位有效数字。)
(16分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
第1步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
第2步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)
△H2=+226.3 kJ·mol-1
H2O(l)+H2NCONH2(l)
△H2=+226.3 kJ·mol-1
(1)写出工业合成尿素的热化学方程式:
(2)下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.添加高效催化剂 D.定时分离尿素
(3)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图所示:
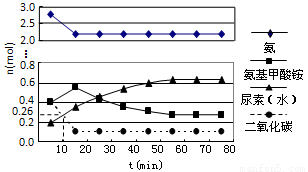
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= 。
(4)工业上合成氨常与尿素生产联合进行以提高经济效益,合成氨的热化学方程式如下:
N2(g) + 3H2(g)  2NH3(g)
△H = —92.4 kJ/mol
2NH3(g)
△H = —92.4 kJ/mol
请在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)。
(5)有一工业投产前小实验:在一定温度和压强下,将6 molH2和2 molN2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数约为11.1%(即1/9),此时H2的转化率是多少?(写出计算过程,计算结果保留3位有效数字。)

(1)在实验室中收集气体C,可选择下图装置中的________________(填选项字母)。

(2)操作②的名称是________________,在操作②中所使用的玻璃仪器的名称是________________。在得到固体D时必须进行洗涤、干燥等操作,洗涤固体D的操作方法是___________________________________________________。
(3)写出下列反应的化学方程式或离子方程式:
反应①______________________________________
反应④______________________________________
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过下图中的装置,其中瓶Ⅰ中盛放的是___________________,瓶Ⅱ中盛放的是_________________________。

(5)实验中必须吸收多余的气体F,以免污染空气。如图所示是实验室用NaOH吸收气体F的装置,为防止产生倒吸现象,合理的装置是__________________________________。

如图所示,实验室用NH4Cl和Ca(OH)2制取NH3。试回答下列问题:
(1)写出反应的化学方程式
(2)B处的药品是
(3)检验D处试管中NH3是否收集满,除用湿红色石蕊试纸外,还可用方法是
(4)在标准状况下,收集到224mlNH3后,将它溶于水中,恰好得到100ml氨水,则最后所得溶液的物质的量浓度为 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com