
题目列表(包括答案和解析)
在适当压力和温度下,4体积某元素的气态氢化物完全分解产生1体积该元素单质蒸气和6体积氢气,此气态氢化物的化学式为
[
]![]()
已知理想气体各参数p(压强)、V(体积)、T(温度)、n(物质的量)满足理想气体状态方程pV=nRT。某学校课外活动小组粗略测定理想气体状态方程中气体常数R的值,下面是测定实验的分析报告,请填写有关空白:
(一)测定原理:在理想气体状态方程pV=nRT中,气体常数R=pV/nT的数值可以通过实验来确定。本实验通过金属镁置换出盐酸中的氢来测定R的值。其反应为:
Mg+2HCl=MgCl2+H2↑
如果称取一定质量的镁与过量的盐酸反应,则在一定温度和压力下,可以通过测出反应放出氢气的体积。实验室的温度和压力可以分别由温度计和气压计测得。氢气物质的量可以通过反应中镁的质量来求得。将以上所得各项数据代入R= pV /nT式中,即可算出R值。
 (二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(三)实验内容:
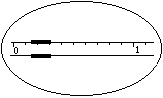
1.在托盘天平上称出镁条的质量(称量镁条天平的游码示数如右图所示,未用砝码,单位为g);
2.按上图搭好仪器。取下试管,移动量气管B,使量气管A中的水面略低于零刻度线,然后将量气管B固定。
3.在试管中加入15mL 6 mol·L-1HCl,不要使盐酸沾湿试管的上半部。将已称重的镁沾少许水,贴在试管上部不与盐酸接触。
4.检查仪器是否漏气,方法如下:(方法要求简单有效)
。
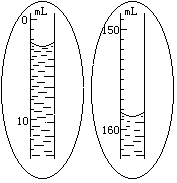 5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
6.轻轻摇动试管,使镁条落入盐酸中,镁条与盐酸反应放出氢气。此时量气管A内水面即开始下降。为了不使量气管A内气压增大而造成漏气,在量气管A内水面下降的同时,慢慢 (上或下)移量气管B,使两管内的水面基本保持水平。反应停止后,待试管冷却至室温(约10分钟),移动量气管B,使两管内的水面相平,读出反应后量气管A内的精确读数V2(如右图所示)。
7.记录实验时的室温t和大气压P。(已知室温为27℃,大气压为100kPa)
(四)数据记录与处理(在横线上填写适当内容):
| 镁条的质量 | w= |
| g |
| 氢气的物质的量 | n= |
| mol |
| 反应前量气管A内读数 | V1= |
| ml |
| 反应后量气管A内读数 | V2= |
| ml |
| 氢气的体积 | V |
| ml |
| 室温 | T |
| K |
| 大气压 | P |
| Pa |
气体常数R的值(计算过程和结果):
(五)问题与讨论:①在读取量气管内气体体积V1时,眼睛仰视读数,结果造成R的测定值 (偏高、偏低或无影响);②若没等反应试管冷却到室温就量取液面的高度,结果造成R的测定值 (偏高、偏低或无影响)。


| 镁条的质量 | w= | | g |
| 氢气的物质的量 | n= | | mol |
| 反应前量气管A内读数 | V1= | | ml |
| 反应后量气管A内读数 | V2= | | ml |
| 氢气的体积 | V | | ml |
| 室温 | T | | K |
| 大气压 | P | | Pa |
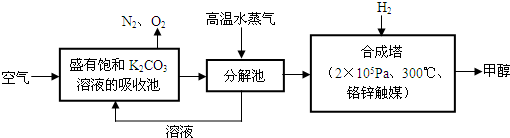
合理利用资源,降低碳的排放,实施低碳经济是今后经济生活主流方向。
⑴下列措施不利于有效减少二氧化碳排放的是 。
A.植树造林,保护森林,保护植被
B.加大对煤和石油的开采,并鼓励使用石油液化气
C.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
D.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率
⑵科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4比例混合通入反应器,适当条件下反应可获得一种能源。完成以下化学方程式:CO2+4H2 +2H2O。
+2H2O。
⑶CO2合成生产燃料甲醇(CH3OH)是碳减排的新方向。进行如下实验:某温度下在1 L的密闭容器中,充2 mol CO2和6 mol H2,发生:CO2(g)+3H2(g ) CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
A.CO2百分含量保持不变
B.容器中H2浓度与CO2浓度之比为3:1
C.容器中混合气体的质量保持不变
D.CO2生成速率与CH3OH生成速率相等
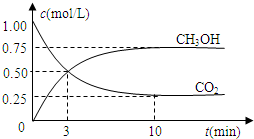
现测得CO2和CH3OH(g)的浓度随时间变化如左下图所示。从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。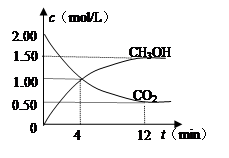
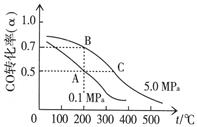
⑷CO在催化作用下也能生成甲醇:CO(g)+2H2(g)  CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
①若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
②若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则A、B两点时容器中,n(A)总︰n(B)总= 。
⑸以KOH为电解质的甲醇燃料电池总反应为:2CH3OH+3O2+4KOH= 2K2CO3+6H2O,通入甲醇的电极为燃料电池的负极,正极发生的电极反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com