
题目列表(包括答案和解析)
(1)已知某混合气体中各成分的体积分数为CH4 80.0%、C2H4 15.0%和C2H6 5.0%.请计算0.500mol该混合气体的质量和标准状况下的密度(g·L-1).
(2)CH4在一定条件下催化氧化可以生在C2H4、C2H6(水和其他反应产物忽略不计).取一定质量的CH4经催化氧化后得到一种混合气体,它在标准状况下的密度为0.780g·L-1.已知反应中CH4消耗了20.0%,计算混合气体中C2H4的体积分数.(本题计算过程中请保留3位有效数字)
已知某固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成,通过推理和计算回答下列问题:
(1)取A与足量盐酸反应,若保持总物质的量不变,不论以何种比例混合,生成气体的量均保持不变,则混合物A的组成情况最多有 种(填数字)。
(2)取A与足量盐酸反应,若保持总质量m(A)不变,不论以何种比例混合,生成气体的量均保持不变,则A的可能组成是
和 、 和 、 和 。(可不填满,也可补充)。
(3)若先将A加热,剩余固体再与足量盐酸反应,且将先后两次生成的气体分别通入足量澄清石灰水中,生成的沉淀均为10.0g,则A中各物质的量之和为 mol。
(4)取ag该混合物与足量盐酸反应生成CO2气体的体积V的取值范围是(标准状况) 。
已知:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①5 min内,消耗N2的平均反应速率为_______________,此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
请回答:
①各物质的平衡浓度可能是_______________.
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l) ![]() 4NH3(g)+3O2(g),此反应的△S__________0(填“
4NH3(g)+3O2(g),此反应的△S__________0(填“![]() ”、 “
”、 “![]() ”或“=”), △H=_____________。
”或“=”), △H=_____________。
(已知:H2的燃烧热为285.8 kJ/mol)
已知:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①5 min内,消耗N2的平均反应速率为_______________,此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
|
| N2 | H2 | NH3 |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
请回答:
①各物质的平衡浓度可能是_______________.
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l) 4NH3(g)+3O2(g),此反应的△S__________0(填“
”、 “
”或“=”), △H=_____________。
(已知:H2的燃烧热为285.8 kJ/mol)
已知:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| | N2 | H2 | NH3 |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
 4NH3(g)+3O2(g),此反应的△S__________0(填“
4NH3(g)+3O2(g),此反应的△S__________0(填“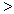 ”、 “
”、 “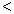 ”或“=”), △H=_____________。
”或“=”), △H=_____________。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com