
题目列表(包括答案和解析)
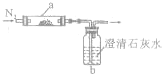 取化学式为XY的黑色粉末状化合物进行如下实验.将XY和足量新制干燥的碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按下图连接仪器进行实验.
取化学式为XY的黑色粉末状化合物进行如下实验.将XY和足量新制干燥的碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按下图连接仪器进行实验.有关元素X、Y、Z、D、E的信息如下
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074 nm。 |
| Y | 所在主族序数与所在周期序数之差为4。 |
| Z | 原子半径为0.102 nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰。 |
| D | 最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子。 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。 |
请回答下列问题:
⑴.X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 ▲ 。
⑵.E元素与Y元素可形成EY2和EY3两种化合物,下列说法不正确的是 ▲ 。(填序号)
①.保存EY2溶液时,需向溶液加入少量E单质。
②.通常实验室配制EY3溶液时,直接用水溶解EY3固体即可。
③.EY2只能通过置换反应生成,EY3只能通过化合反应生成。
④.铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒。
⑤.向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都可变为紫色。
⑶.用化学符号表示D2Z的水溶液中各离子浓度从大到小的顺序是 ▲ 。
 ⑷.将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰
⑷.将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰
好完全反应(已知反应过程放热),生成物中有三种含Y元
素的离子,其中两种离子的物质的量(n)与反应时间(t)
的变化示意图如右图所示。
则该苛性钾溶液中所含KOH的质量是 ▲ g,
该反应中转移电子的物质的量是 ▲ mol。
 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O 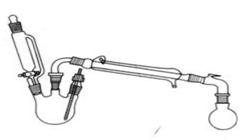
| | 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | ~117 | 溶 |
| 乙酸乙酯 | 0.902 | ?84 | ~76.5 | 不溶 |
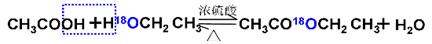
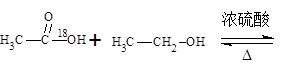

实验室制备乙酸乙酯的反应和实验装置如下:
CH3COOH + C2H5OH  CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 产率 65%
1 : 10 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
| | 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | ~117 | 溶 |
| 乙酸乙酯 | 0.902 | ?84 | ~76.5 | 不溶 |




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com