
题目列表(包括答案和解析)
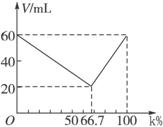
在一定温度、压强和有催化剂存在时,将氮气和氢气按1:3(体积比)混和,当反应达到平衡时混合气体中氨气占25%(体积比).如果混和前氮气为100 mol,达到平衡时:
(1)n(N2)= mol;n(H2)= mol;n(NH3)= mol。
(2)N2的转化率为 。
在一定温度、压强和有催化剂存在时,将氮气和氢气按1∶3(体积比)混和,当反应达到平衡时,混合气体中氨气占25%(体积比).如果混和前氮气为100 mol,达到平衡时:
(1)n(N2)=________mol;n(H2)=________mol;n(NH3)=________mol.
(2)N2的转化率为________.
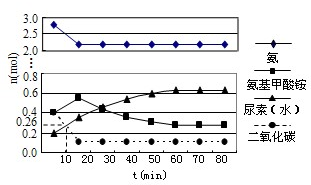
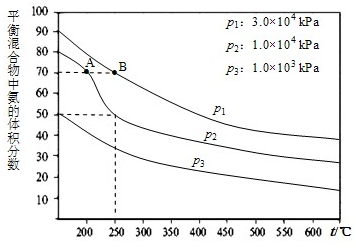 在工业合成尿素时常用NH3与CO2作原料进行生产.
在工业合成尿素时常用NH3与CO2作原料进行生产.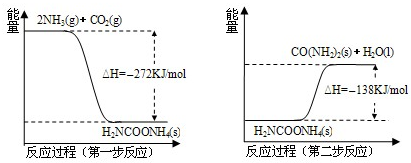
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com