
题目列表(包括答案和解析)
 ”表示在空气中形成酸雨的两条途径:
”表示在空气中形成酸雨的两条途径: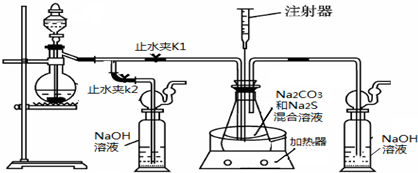
| 0.496v |
| m |
| 0.496v |
| m |
| 实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
| 1 | 10 | 1.5:1 | 100 | 18 | 80.7% |
| 2 | a | 1.1:1 | 100 | 18 | 94.6% |
大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有________(填字母).
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g+2H2O(g) ΔH2=-1160 kJ·mol-1
2N2(g)+CO2(g+2H2O(g) ΔH2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为________.
(3)脱碳.将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数![]() (CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的ΔH3________0(填“>”、“<”或“=”).
(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的ΔH3________0(填“>”、“<”或“=”).

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如下图所示.下列说法正确的是________(填字母代号).

A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时C(CH3OH)=1.5 mol/L
B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min)
C.达到平衡时,氢气的转化率为75%
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)减小
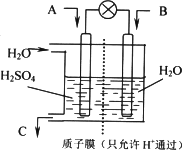
③有学者设想以下图所示装置用电化学原理将CO2转化为重要化工原料.若A为CO2,B为H2,C为CH3OH,则正极电极反应式为________.
(4)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:________;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中[Na+]+[H+]________[NO3-]+[OH-](填写“>”“=”或“<”)
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
(1)写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
(2)下列能说明碳与硫两元素非金属性相对强弱的是 。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(3)羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式 ,负极的反应产物为 (填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:COS + H2 CO + H2S
CO + H2S
(4)已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K ,反应速率 (均选填“增大”、“减小”、“不变”)。
(5)若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是 。
a.容器内气体密度保持不变 b.容器内温度保持不变
c.c(H2)=c(H2S) d.υ(H2)正=υ(H2S)正
(6)已知该反应的平衡常数很大,说明 。
 CO + H2S
CO + H2S 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com