
题目列表(包括答案和解析)
| 0.496v |
| m |
| 0.496v |
| m |
| 实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
| 1 | 10 | 1.5:1 | 100 | 18 | 80.7% |
| 2 | a | 1.1:1 | 100 | 18 | 94.6% |
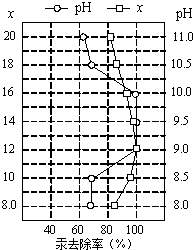 (4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示).为使除汞效果最佳,应控制的条件是
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示).为使除汞效果最佳,应控制的条件是A.氢氧化钠溶液 B.稀硫酸 C.盐酸 D.氢氧化钙溶液
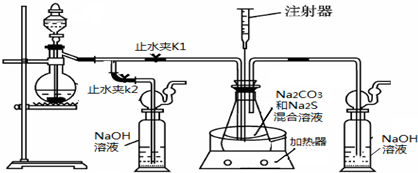
(16分)硫化钠和碳酸钠为原料、采用下述装置制备硫代硫酸钠,制备反应可表示为:
2Na2 S +Na2CO3 + 4SO2 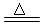 3Na2S2O3 +CO2。根据要求回答问题:
3Na2S2O3 +CO2。根据要求回答问题: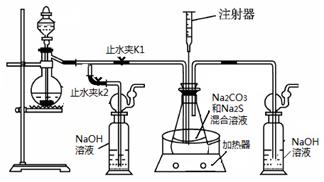
(1)实验时,打开K1,关闭K2,最后洗气瓶中发生反应的离子方程式是 。
(2)锥形瓶内溶液pH小于7时会导致产品分解,因此实验过程中需要控制锥形瓶内溶液的pH。
①反应过程中,锥形瓶中溶液pH将________(填“增大”、“减小”或“保持不变”)。
②测量锥形瓶中溶液pH时,用注射器吸取溶液样品比直接打开锥形瓶中瓶塞取样,除操作简便外,还具有的优点是 。
③若实验过程中测得溶液pH已接近于7。此时应该进行的操作是 。
(3)已知:2Na2 S2O3 +I2="2NaI+" Na2 S4O6。实验结束后进行相关处理,可即获得Na2 S2O3 ·5H2O晶体。为测量其纯度,取晶体样品mg,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液vmL,则该样品纯度是 。
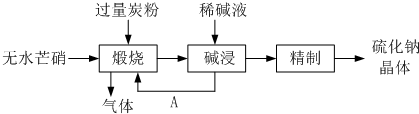
(4)制取硫代硫酸钠的另一种方法是直接将硫粉和亚硫酸钠、水混合共热制取。为探究制取硫代硫酸钠最佳条件(溶液pH、亚硫酸钠浓度、反应温度、硫粉质量),设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
| 实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
| 1 | 10 | 1.5:1 | 100 | 18 | 80.7% |
| 2 | a | 1.1:1 | 100 | 18 | 94.6% |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com