
题目列表(包括答案和解析)
 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质. 2NH3△H=-92.4kJ?mol-1
2NH3△H=-92.4kJ?mol-1| 4 |
| a2 |
| 4 |
| a2 |
 2BO3(g);△H=-196.6kJ?mol-1
2BO3(g);△H=-196.6kJ?mol-1 2NGH3(g);△H=-92.4kJ/mol
2NGH3(g);△H=-92.4kJ/mol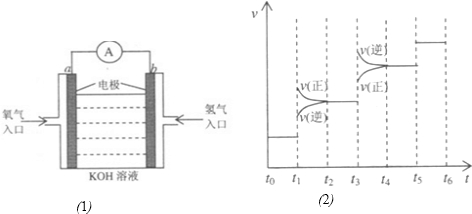
| 4 |
| a2 |
| 4 |
| a2 |
(1)常温下,X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式_______________________________________。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为_______________________________________。
(4)化学反应![]() 2CA3(g)。
2CA3(g)。
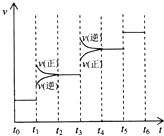
当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是________________________。温度为T ℃时,将

(5)化合物A8B4D2有如下转化关系:
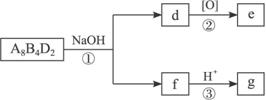
其中,g是常用调味品的主要成分。写出反应①的化学方程式__________________________。
设计实验方案完成d→e的转化____________________________________________________。
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为 。
(4)化学反应3A2(g)+C2(g) ![]() 2CA3(g)。当反应达到平衡时不断
2CA3(g)。当反应达到平衡时不断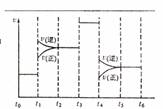
改变条件(不改变A2、C2和CA3的量),右图表示反应速度与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。温度为T℃时,将4amolA2和2amolC2放入密闭容器中,充分
反应后测得C2的转化率为50%,则反应的平衡常数 。
(5)化合物A8B4D2有如下转化关系:
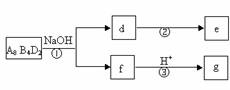
其中,g是常用调味品的主要成分。写出反应①的化学方程式
。
设计实验方案完成d→e的转化
。
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
元素编号 元素特征信息
A A的单质是密度最小的物质
B B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子
C C的原子最外层电子数是其内层电子数的三倍
D D与B同周期,该周期中D的简单离子半径最小
E B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分
F F元素最高正价与最低负价的代数和为4
(1)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式
(2)D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示) 。
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等。则原混合物中D单质的质量分数
为 。
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。此时反应的化学方程式为 。

(5)A、B形成的化合物BA在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的钠的化合物。写出它与乙醇反应的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com