
题目列表(包括答案和解析)
将由CaCO3、MgCO3组成的混合物充分加热至质量不再减少时,称得残留物的质量为原混合物的一半,则残留物中Ca、Mg两元素原子的物质的量之比是多少?
将由CaCO3和MgCO3组成的混合物充分加热至质量不减少时,称得残留物的质量是原混合物的一半,则残留物中的Ca、Mg两元素的物质的量之比是
[ ]
A.1∶1 B.1∶2 C.1∶3 D.2∶1
| 实验步骤 | 预期现象和结论 |
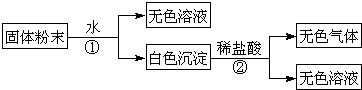
| 步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B. | / |
| 步骤2: |
|
| 步骤3: |
| 序号 | 化学式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
| A、等质量的固体硫和硫蒸气分别完全燃烧生成相同状态下的SO2,后者放出的热量少 | B、由C(金刚石,s)=C(石墨,s)△H=-1.90 kJ?mo1-1,可知金刚石比石墨稳定 | C、由CaCO3(s)=CaO(s)+C02(g)△H=+178.5 kJ?mo1-1,可知反应物的总能量小于生成物的总能量 | D、在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1.若将含l mol CH3COOH的稀溶液与含l mol NaOH的稀溶液混合,放出的热量大于57.3 kJ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com