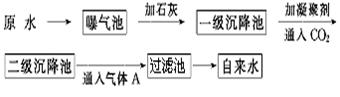
[化学-物质结构与性质]
铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
(1)基态铬原子的价电子排布式为
.
(2)CrO
2Cl
2和NaClO均可作化工生产的氧化剂或氯化剂.制备CrO
2Cl
2的反应为:K
2 Cr
2O
2+3CCl
4 2KC+2CrO
2Cl
2+3COCl
2↑.
①上述反应式中非金属元素电负性由大到小的顺序是
(用元素符号表示).
②常温时CrO
2Cl
2是一种易溶于CCl
4的液体,则固态CrO
2Cl
2属于
晶体.
③COCl
2分子中所有原子均满足8电子构型,COCl
2分子中σ键和π键的个数比为
.
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni
2+和Fe
2+的离子半径分别为6.9×10
-2nm和7.8×10
-2nm.则熔点:NiO
FeO(填”<”、“=”或“>”).
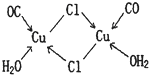
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu
2Cl
2(CO)
2?2H
2O],其结构如图.下列说法不正确的是
.(填标号)
A.该复合物中存在化学健类型只有离子键、配位键
B.该复合物中Cl原子的杂化类型为sp
3C.该复合物中只有CO和H
2O作为配位体
D.CO与N
2的价电子总数相同,其结构为C≡O
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH
3)
4]
2+配离子.已知NF
3与NH
3的空间构型都是三角锥形,但NF
3不易与Cu
2+形成配离子,其原因是
.