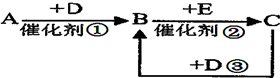
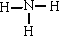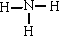A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
| 元素 |
有关信息 |
| A |
最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B |
地壳中含量最多的元素 |
| C |
单质须保存在煤油中 |
| D |
单质与NaOH溶液反应可用于生产漂白液 |
| E |
单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)A的氢化物分子的电子式是
,其水溶液能使酚酞变红的原因用电离方程式解释为:
NH
3?H
2O

NH
4++OH
-NH
3?H
2O

NH
4++OH
-.
(2)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法是:
取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生)
取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生)
,证明存在该阳离子.
(3)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为
离子键和共价键
离子键和共价键
.
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:
①③
①③
.
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)E制品通常在潮湿空气中发生电化学腐蚀,该过程的正极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.
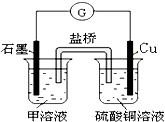
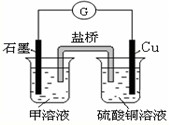
(6)若在D与E组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极出现的现象是
黄色溶液慢慢变为浅绿色
黄色溶液慢慢变为浅绿色
,负极的反应式为:
Cu-2e-=Cu2+
Cu-2e-=Cu2+
.

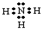
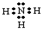
 NH4++OH-
NH4++OH- NH4++OH-
NH4++OH-