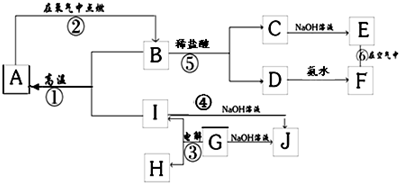
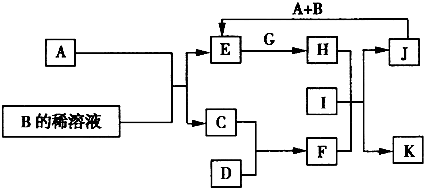
A~L为中学化学常见的物质,其主要转化关系如图所示(其中产物水已略去).已知A为常见的金属单质,C、D通常状况下为气体单质,B、F均为重要的化工产品,B的浓溶液具有较强的腐蚀性,F为具有刺激性气味的气体.将一定量的F通入B的稀溶液中可以生成两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
试回答下列问题:
(1)B的化学式为
H2SO4
H2SO4
;工业上冶炼金属A的方法称为
热还原法
热还原法
.
(2)向E的溶液中加入氢氧化钠溶液的实验现象为
先生成白色沉淀,迅速变为灰绿色,最后变为红褐色
先生成白色沉淀,迅速变为灰绿色,最后变为红褐色
,发生反应的化学方程式为
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
.
(3)写出E的酸性溶液与G反应生成H的离子方程式:
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.
(4)检验H溶液中的阳离子应选用试剂为,实验现象为
溶液由黄色变为血红色
溶液由黄色变为血红色
.
(5)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为pH(K溶液)
>
>
pH(L溶液)(填“>”、“<”或“=”),其主要原因是
NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-
NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-
(用离子方程式解释).