脱硫技术能有效控制SO
2对空气的污染.
(1)向煤中加入石灰石可减少燃烧产物中SO
2的含量,该反应的化学方程式是
2SO2+O2+2CaCO3=2CaSO4+2CO2
2SO2+O2+2CaCO3=2CaSO4+2CO2
.
(2)海水呈弱碱性,主要含有Na
+、K
+、Ca
2+、Mg
2+、Cl
-、SO
42-、Br
-、HCO
3-等离子.含SO
2的烟气可利用海水脱硫,其工艺流程如下图所示:
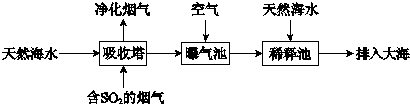
①向曝气池中通入空气的目的是
将H2SO3、HSO3-等氧化为SO42-
将H2SO3、HSO3-等氧化为SO42-
.
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是
bd
bd
.
a.Cl
- b.SO
42- c.Br
- d.HCO
3-(3)用NaOH溶液吸收烟气中的SO
2,将所得的Na
2SO
3溶液进行电解,可循环再生NaOH,同时得到H
2SO
4,其原理如下图所示.(电极材料为石墨)
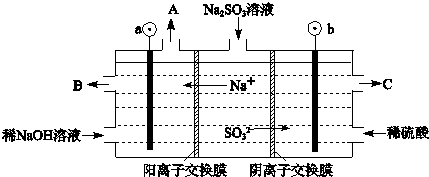
①图中a极要连接电源的(填“正”或“负”)
负
负
极,C口流出的物质是
硫酸
硫酸
.
②SO
32-放电的电极反应式为
SO32--2e-+H2O=SO42-+2H+
SO32--2e-+H2O=SO42-+2H+
.
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因
H2O?H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
H2O?H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
.

 (2012?青浦区二模)硫-碘循环分解水制氢的主要反应如下:
(2012?青浦区二模)硫-碘循环分解水制氢的主要反应如下: (2010?山东)硫一碘循环分解水制氢主要涉及下列反应:
(2010?山东)硫一碘循环分解水制氢主要涉及下列反应: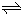 H2+I2
H2+I2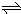 2HI(g)的平衡常数K=
2HI(g)的平衡常数K=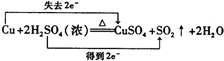



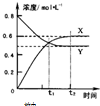 (2009?深圳二模)一定条件下在固定容积的密闭容器中充入a molO2和b mol SO2发生反应:2SO2+O2?2SO3.反应过程中物质的浓度变化如图所示.下列有关判断正确的是( )
(2009?深圳二模)一定条件下在固定容积的密闭容器中充入a molO2和b mol SO2发生反应:2SO2+O2?2SO3.反应过程中物质的浓度变化如图所示.下列有关判断正确的是( )