
题目列表(包括答案和解析)
金属元素锡(Sn)和碳元素位于同一主族,主要化合价为+2和+4.某同学通过下列方法测定金属锡样品的纯度:(假定杂质不参加反应)
(1)将试样溶于盐酸中,反应的化学方程式为:________.
(2)加入过量的FeCl3溶液,反应的化学方程式为:________.
(3)用已知浓度的K2Cr2O7酸性溶液滴定生成的Fe2+.反应的离子方程式为:________.
(4)现有金属锡样品1.142 g,经上述各步反应后,共用去0.100 mol/L的K2Cr2O7溶液16.0 ml.则试样中锡的质量分数?________.
(5)步骤(4)中如果取用16.00 ml的K2Cr2O7溶液则应用________(填仪器名称).该同学在配制0.100 mol/L的试验中,若其他步骤都正确,但定容时俯视刻度线则所得溶液的浓度________(填偏高,偏低,或无影响)
金属元素锡(Sn)和碳元素位于同一主族,主要化合价为+2和+4.某同学通过下列方法测定金属锡样品的纯度,步骤如下:(假定杂质不参加反应)
(1)将试样溶于盐酸中,反应的化学方程式为:________.
(2)在(1)反应后的溶液中加入过量的FeCl3溶液,反应的化学方程式为:________.
(3)用已知浓度的K2Cr2O7酸性溶液滴定生成的Fe2+.反应的离子方程式为:________
(4)现有金属锡样品1.142 g,经上述各步反应后,共用去0.100 mol/L的K2Cr2O7溶液16.0 ml.则试样中锡的质量分数?________
(5)步骤(4)中如果取用16.00 ml的K2Cr2O7溶液则应用________(填仪器名称).该同学在配制0.100 mol/L K2Cr2O7溶液的试验中,若其他步骤都正确,但定容时俯视刻度线则所得溶液的浓度________(填偏高,偏低,或无影响)
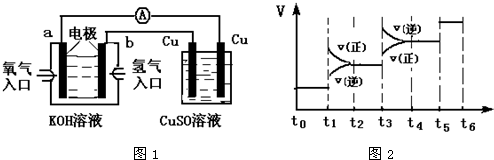
| 1 |
| 2 |
| 1 |
| 2 |
| 4 |
| a2 |
| 4 |
| a2 |
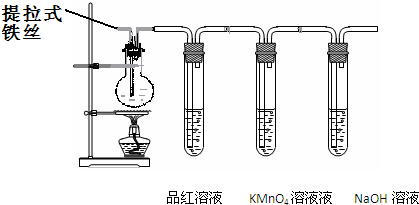
| 1 |
| 2 |
| 1 |
| 2 |
| a |
| 56 |
| b |
| 22.4 |
| a |
| 56 |
| b |
| 22.4 |
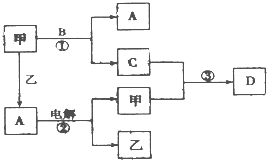 A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com