
题目列表(包括答案和解析)
根据你的生活经验和表所提供的信息,分析并回答下列问题。
|
物理性质 |
物理性质比较 |
|
导电性(以银为100) |
银 铜 金 铝 锌 铁 铅 |
|
100 99 74 61 27 17 7.9 |
|
|
密度 (g/cm3) |
金 铅 银 钢 铁 锌 铝 |
|
19.3 11.3 10.5 8.92 7.86 7.14 2.70 |
|
|
熔点(℃) |
钨 铁 铜 金 银 铝 锡 |
|
3410 1535 1083 1064962 660 232 |
|
|
硬度(以金刚石为10) |
铬 铁 银 铜 金 铝 铅 |
|
9 4~5 2.5~4 2.5~3 2.5~3 2~2.9 1.5 |
(1)为什么菜刀、锤子等通常用铁制而不用铅制?
(2)银的导电性比铜好,为什么导线一般用铜制而不用银制?
(3)为什么灯泡里的灯丝用钨制而不用锡制?
|
某温度下,将 | |
| [ ] | |
A. |
21∶5 |
B. |
4∶1 |
C. |
3∶1 |
D. |
11∶3 |
若用浓度为0.20mol×L-1的标准盐酸滴定氢氧化钠溶液,再用此氢氧化钠溶液滴定未知浓度的盐酸,滴定时记录了以下2组数据:
滴定次数 待测碱溶液
体积V/mL 标准酸溶液的体积
滴定前刻度 滴定后刻度 体积/mL
第一次 10.0 0.0 10.4
第二次 10.0 12.2 22.8
滴定次数 待测溶液
体积V/mL 碱溶液的体积
滴定前刻度 滴定后刻度 体积/mL
第一次 0.0 11.1
第二次 11.3 22.2
由以上数据算出碱液浓度为________mol×L-1,酸液浓度为________mol×L-1。
滴定次数 待测碱溶液
体积V/mL 标准酸溶液的体积
滴定前刻度 滴定后刻度 体积/mL
第一次 10.0 0.0 10.4
第二次 10.0 12.2 22.8
滴定次数 待测溶液
体积V/mL 碱溶液的体积
滴定前刻度 滴定后刻度 体积/mL
第一次 0.0 11.1
第二次 11.3 22.2
由以上数据算出碱液浓度为________mol×L-1,酸液浓度为________mol×L-1。
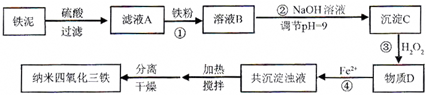
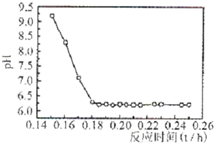
| 实验序号 | 双氧水(mL) | pH | 反应时间 |
| 1 | 0.5 | 11 | 3 |
| 2 | 0.4 | 11 | 3 |
| 3 | 0.6 | 11 | 3 |
| 4 | 0.5 | 10 | 3 |
| 5 | |||
| 6 | |||
| 7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com