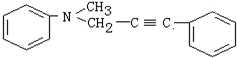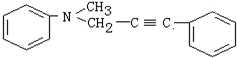常温下,如果取0.2mol/LCH
3COOH溶液与0.2mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的PH=9,试回答以下问题:
(1)写出该混合过程中所发生反应的离子方程式:
HAc+OH-=Ac-+H2O
HAc+OH-=Ac-+H2O
,混合溶液的PH=9的原因是:(用必要的文字和离子方程式表示)
Ac-离子水解显碱性,离子反应为Ac-+H2O?HAc+OH-
Ac-离子水解显碱性,离子反应为Ac-+H2O?HAc+OH-
.
(2)混合溶液中由水电离出的c(H
+)和PH=9的NaOH溶液中由水电离出c(H
+)的比值为
104:1
104:1
.
(3)求混合溶液中下列算式的计算结果:
c(Na
+)-c(CH
3COO
-)=
10-5-10-9
10-5-10-9
mol/L(列出算式即可)
c(OH
-)-c(CH
3COOH)=
10-9
10-9
moL/L(写出精确结果.)
(4)若HCl溶液与NaOH溶液反应的中和热数值为53.7kJ/mol,则1molCH
3COOH与1mol NaOH在溶液中反应所放出的热与57.3kJ/mol相比会
偏小
偏小
(“相等”或“偏大”、“偏小”.)
(5)将同温度下等浓度的下列四种盐溶液:
A.NH
4HCO
3 B.NH
4Cl C.(NH
4)
2SO
4 D.CH
3COONH
4按PH由大到小的顺序排列:
ADBC
ADBC
(填字母序号.)






 )分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为
)分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为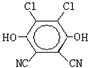

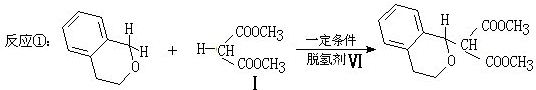
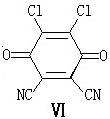
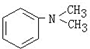 与1分子
与1分子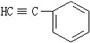 在一定条件下可发生类似①的反应,其产物分子的结构简式为
在一定条件下可发生类似①的反应,其产物分子的结构简式为