
题目列表(包括答案和解析)
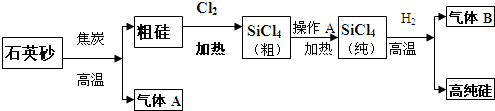
| ||
| ||
(共14分)
(1)下列操作错误的是_________(填序号)
A. 用蒸发皿进行加热蒸发实验时,不垫石棉网。
B. 浓硫酸不慎沾到皮肤上,迅速用NaOH溶液清洗,再用水洗。
C. 蒸馏时,将温度计水银球插入液面以下。
D. 闻气体气味时,用手在容器口轻轻扇动,使少量气体飘入鼻孔中。
E. 使用分液漏斗和容量瓶时,首先检查是否漏液。
(2) 最近媒体报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84
消毒液”(有效成分是NaClO)发生氯气中毒的事件。根据你所学的氧化还原反应知识,用
离子方程式表示产生氯气的原因:
(3) 已知向偏铝酸钠溶液中加入稀盐酸有氢氧化铝生成。某同学根据所学知识,提出不能使用该方法制取A1(OH)3,理由为 。(用离子方程式表示)请你另举出一种用氯化铝溶液制取A1(OH)3的合理方法,该反应的离子方程式为 。
(4)据有关报道。目前已能冶炼出纯度高达99.9999%的铁,下列关于纯铁的叙述中,正确的是 (填字母)。
A.硬度比钢小,熔点比钢高 B.不能与盐酸反应
C.与不锈钢成分相同 D.在冷的浓硫酸中钝化
(5)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时停止加热,所得分散系的分散质大小范围是 。
(6)合成氨工业生产中常用铁触媒做催化剂,其主要成分是FeO、Fe2O3。已知某铁触媒中,铁、氧离子的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为 。
(共14分)
(1)下列操作错误的是_________(填序号)
A. 用蒸发皿进行加热蒸发实验时,不垫石棉网。
B. 浓硫酸不慎沾到皮肤上,迅速用NaOH溶液清洗,再用水洗。
C. 蒸馏时,将温度计水银球插入液面以下。
D. 闻气体气味时,用手在容器口轻轻扇动,使少量气体飘入鼻孔中。
E. 使用分液漏斗和容量瓶时,首先检查是否漏液。
(2) 最近媒体报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84
消毒液”(有效成分是NaClO)发生氯气中毒的事件。根据你所学的氧化还原反应知识,用
离子方程式表示产生氯气的原因:
(3) 已知向偏铝酸钠溶液中加入稀盐酸有氢氧化铝生成。某同学根据所学知识,提出不能使用该方法制取A1(OH)3,理由为 。(用离子方程式表示)请你另举出一种用氯化铝溶液制取A1(OH)3的合理方法,该反应的离子方程式为 。
(4)据有关报道。目前已能冶炼出纯度高达99.9999%的铁,下列关于纯铁的叙述中,正确的是 (填字母)。
A.硬度比钢小,熔点比钢高 B.不能与盐酸反应
C.与不锈钢成分相同 D.在冷的浓硫酸中钝化
(5)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时停止加热,所得分散系的分散质大小范围是 。
(6)合成氨工业生产中常用铁触媒做催化剂,其主要成分是FeO、Fe2O3。已知某铁触媒中,铁、氧离子的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为 。
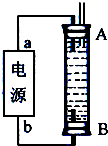
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO。PdCl2被还原成单质,反应的化学方程式为 ;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
①负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
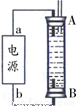
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为 (填“吸”或“放”)热反应;
②实验2中,平衡常数K= ;
③实验3跟实验2相比,改变的条件可能是 (答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com